Enzymy: definicja, mechanizm działania i znaczenie w organizmach
Poznaj enzymy: definicja, mechanizm działania i ich kluczowe znaczenie w organizmach — jak przyspieszają reakcje, typy, przykłady i zastosowania w biologii i medycynie.
Enzymy to cząsteczki białka w komórkach, które działają jak biologiczne katalizatory. Enzymy przyspieszają reakcje chemiczne w organizmie, ale nie zużywają się w tym procesie, dlatego mogą być wielokrotnie wykorzystywane. Dzięki swojej budowie i właściwościom obniżają energię aktywacji reakcji, co pozwala na przebieg procesów biochemicznych w warunkach panujących w komórkach.
Prawie wszystkie reakcje biochemiczne w organizmach żywych wymagają enzymów. Dzięki enzymowi reakcje chemiczne przebiegają znacznie szybciej niż bez niego. p39 Innymi biokatalizatorami są katalityczne cząsteczki RNA, zwane rybozymami.
Substancje znajdujące się na początku reakcji nazywamy substratami. Substancje znajdujące się na końcu reakcji to produkty. Enzymy wiążą substraty w tzw. miejscu aktywnym i przekształcają je w produkty, po czym mogą ponownie uczestniczyć w kolejnych cyklach katalizy. Nauka o enzymach nazywana jest enzymologią.
Budowa enzymów i specyficzność
Większość enzymów jest zbudowana z jednego lub więcej łańcuchów polipeptydowych, których przestrzenne ułożenie tworzy miejsce aktywne — miejsce wiązania substratu. Do prawidłowego działania niektórych enzymów potrzebne są dodatkowe elementy zwane kofaktorami. Mogą to być jony metali (np. Zn2+, Mg2+) lub organiczne cząsteczki zwane koenzymami (np. NAD+, FAD). Jeśli kofaktor jest trwale związany z enzymem, nazywa się on grupą prostetyczną.
Specyficzność enzymu oznacza, że dany enzym rozpoznaje określony substrat lub grupę substratów — mówi się o specyficzności substratowej. Klasyczne modele wyjaśniające wiązanie enzym–substrat to model „klucza i zamka” oraz model „indukowanego dopasowania”, w którym enzym zmienia konformację przy wiązaniu substratu, optymalizując katalizę.
Mechanizm działania
Enzymy przyspieszają reakcje poprzez obniżenie energii aktywacji i stabilizację stanu przejściowego. Mechanizmy, które to umożliwiają, obejmują:
- zmniejszenie odległości pomiędzy substratami,
- odpowiednie ułożenie substratów względem siebie,
- tworzenie środowiska chemicznego sprzyjającego reakcji (np. przenoszenie protonów),
- tymczasowe tworzenie i rozrywanie wiązań między enzymem a substratem.
W biochemii często używa się opisu kinetycznego reakcji enzymatycznych, w tym równań Michaelisa–Menten, które wprowadzają parametry takie jak Vmax (maksymalna prędkość reakcji) i Km (stała Michaelisa, miara powinowactwa enzymu do substratu).
Czynniki wpływające na aktywność enzymów
- Temperatura: wzrost temperatury zwykle zwiększa szybkość reakcji do czasu, gdy białko nie ulegnie denaturacji; większość enzymów ma optymalne zakresy temperaturowe.
- pH: zmiany pH wpływają na jonizację grup funkcyjnych reszt aminokwasowych, co może prowadzić do utraty aktywności. Enzymy mają różne optimum pH (np. pepsyna w żołądku działa najlepiej w kwaśnym środowisku).
- Stężenie substratu: wzrost stężenia substratu zwiększa szybkość reakcji aż do osiągnięcia nasycenia enzymu.
- Inhibitory: substancje hamujące aktywność enzymów — mogą być odwracalne (konkurencyjne, niekonkurencyjne, niezależne) lub nieodwracalne (trwale modyfikujące enzym).
Regulacja aktywności enzymatycznej
Organizmy regulują aktywność enzymów na wiele sposobów, aby kontrolować szlaki metaboliczne:
- Regulacja allosteryczna: modulatory (aktywatory lub inhibitory) wiążą się w miejscach innych niż aktywne, zmieniając konformację enzymu.
- Modyfikacje kowalencyjne: np. fosforylacja/dezfosforylacja, które włączają lub wyłączają aktywność enzymu.
- Kontrola ekspresji genów: zmiana ilości syntetyzowanego enzymu przez regulację transkrypcji i translacji.
- Sprzężenie zwrotne (feedback): końcowy produkt szlaku metabolicznego może hamować enzymy na wczesnym etapie tego szlaku.
Przykłady i znaczenie
Przykładowe enzymy to amylaza (rozkłada skrobię), pepsyna (trawi białka w żołądku), lipazy (rozkładają tłuszcze), kinazy i dehydrogenazy (uczestniczą w przenoszeniu grup i elektronów w metabolizmie). Enzymy są kluczowe w:
- metabolizmie komórkowym i produkcji energii (np. enzymy oddychania komórkowego),
- trawieniu i wchłanianiu składników odżywczych,
- replikacji i naprawie DNA (polimerazy, ligazy),
- przemysłowych zastosowaniach: w przemyśle spożywczym, detergentowym, farmaceutycznym i biotechnologii (np. enzymy w produkcji serów, wytwarzaniu bioetanolu, enzymy stosowane w diagnostyce).
Znaczenie medyczne
Zaburzenia aktywności enzymów mogą prowadzić do chorób metabolicznych (np. fenyloketonuria — brak enzymu przekształcającego fenyloalaninę). Enzymy są także istotnymi celami leków — wiele leków działa jako inhibitory specyficznych enzymów patogenu lub szlaku metabolicznego gospodarza. W diagnostyce oznaczanie aktywności enzymów (np. enzymów wątrobowych) pomaga w wykrywaniu uszkodzeń narządów.
Nazewnictwo i klasyfikacja
Większość enzymów nosi nazwy zakończone przyrostkiem „-aza” (np. laktoza → laktaza), a Międzynarodowa Komisja Enzymatyczna nadaje numery klasyfikacyjne (EC) według typu katalizowanej reakcji.
Pierwszy enzym został odkryty w 1833 roku przez Anselme Payena.
Oprócz enzymów białkowych, jak wspomniano wcześniej, istnieją również enzymatyczne cząsteczki RNA — rybozymy — które pełnią ważne funkcje katalityczne w komórkach. Badania nad enzymami wciąż rozwijają się, dostarczając nowych narzędzi w medycynie, biotechnologii i ochronie środowiska.
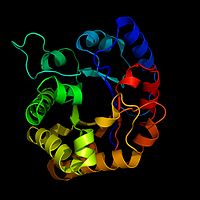
Schemat prążkowy enzymu zwanego TIM

Schemat prążkowy enzymu zwanego TIM
Struktura enzymu
Istnieją tysiące różnych enzymów, a każdy z nich jest specyficzny dla reakcji, którą katalizuje. Enzymy mają nazwy, które pokazują, co robią. Nazwy enzymów zazwyczaj kończą się na -aza, aby pokazać, że są to enzymy. Przykładem tego jest syntaza ATP. Wytwarza ona substancję chemiczną zwaną ATP. Innym przykładem jest polimeraza DNA. Odczytuje ona nienaruszoną nić DNA i używa jej jako szablonu do stworzenia nowej nici.Jednym z przykładów enzymu jest amylaza, występująca w ślinie. Rozbija ona cząsteczki skrobi na mniejsze cząsteczki glukozy i maltozy. Innym rodzajem enzymu jest lipaza. Rozkłada ona tłuszcze na mniejsze cząsteczki, kwasy tłuszczowe i glicerol.d
Proteazy to cała klasa enzymów. Rozkładają one inne enzymy i białka z powrotem na aminokwasy. Nukleazy to enzymy, które tną DNA lub RNA, często w określonym miejscu cząsteczki.
Enzymy służą nie tylko do rozkładania dużych związków chemicznych na mniejsze. Inne enzymy biorą mniejsze związki chemiczne i budują je w większe związki chemiczne, a także wykonują wiele innych zadań chemicznych. Poniższa klasyfikacja wymienia główne typy.
Biochemicy często rysują obraz enzymu, aby wykorzystać go jako pomoc wizualną lub mapę enzymu. Jest to trudne do zrobienia, ponieważ w enzymie mogą znajdować się setki lub tysiące atomów. Biochemicy nie są w stanie narysować wszystkich tych szczegółów. Zamiast tego, używają modeli wstęgowych jako obrazów enzymów. Modele wstęgowe mogą pokazać kształt enzymu bez konieczności rysowania każdego atomu.
Większość enzymów nie będzie działać, jeśli temperatura i pH nie będą odpowiednie. U ssaków właściwa temperatura to zazwyczaj około 37oC (temperatura ciała). Prawidłowe pH może się znacznie różnić. Pepsyna jest przykładem enzymu, który działa najlepiej, gdy pH wynosi około 1,5.
Podgrzanie enzymu powyżej pewnej temperatury spowoduje jego trwałe zniszczenie. Zostanie on rozłożony przez proteazę i chemikalia będą mogły być ponownie wykorzystane.
Niektóre substancje chemiczne mogą pomóc enzymowi w jeszcze lepszym wykonywaniu jego pracy. Są to tzw. aktywatory. Czasami substancja chemiczna może spowolnić działanie enzymu lub nawet sprawić, że enzym w ogóle nie będzie działał. Są to tzw. inhibitory. Większość leków to substancje chemiczne, które albo przyspieszają, albo spowalniają działanie jakiegoś enzymu w organizmie człowieka.
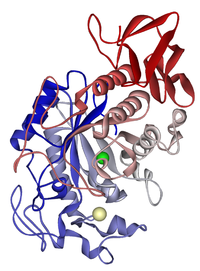
Amylaza ślinowa: jon chlorkowy zielony; wapń beżowy
Struktura enzymu
Istnieją tysiące różnych enzymów, a każdy z nich jest specyficzny dla reakcji, którą katalizuje. Enzymy mają nazwy, które pokazują, co robią. Nazwy enzymów zazwyczaj kończą się na -aza, aby pokazać, że są to enzymy. Przykładem tego jest syntaza ATP. Wytwarza ona substancję chemiczną zwaną ATP. Innym przykładem jest polimeraza DNA. Odczytuje ona nienaruszoną nić DNA i używa jej jako szablonu do stworzenia nowej nici.Jednym z przykładów enzymu jest amylaza, występująca w ślinie. Rozbija ona cząsteczki skrobi na mniejsze cząsteczki glukozy i maltozy. Innym rodzajem enzymu jest lipaza. Rozkłada ona tłuszcze na mniejsze cząsteczki, kwasy tłuszczowe i glicerol.d
Proteazy to cała klasa enzymów. Rozkładają one inne enzymy i białka z powrotem na aminokwasy. Nukleazy to enzymy, które tną DNA lub RNA, często w określonym miejscu cząsteczki.
Enzymy służą nie tylko do rozkładania dużych związków chemicznych na mniejsze. Inne enzymy biorą mniejsze związki chemiczne i budują je w większe związki chemiczne, a także wykonują wiele innych zadań chemicznych. Poniższa klasyfikacja wymienia główne typy.
Biochemicy często rysują obraz enzymu, aby wykorzystać go jako pomoc wizualną lub mapę enzymu. Jest to trudne do zrobienia, ponieważ w enzymie mogą znajdować się setki lub tysiące atomów. Biochemicy nie są w stanie narysować wszystkich tych szczegółów. Zamiast tego, używają modeli wstęgowych jako obrazów enzymów. Modele wstęgowe mogą pokazać kształt enzymu bez konieczności rysowania każdego atomu.
Większość enzymów nie będzie działać, jeśli temperatura i pH nie będą odpowiednie. U ssaków właściwa temperatura to zazwyczaj około 37oC (temperatura ciała). Prawidłowe pH może się znacznie różnić. Pepsyna jest przykładem enzymu, który działa najlepiej, gdy pH wynosi około 1,5.
Podgrzanie enzymu powyżej pewnej temperatury spowoduje jego trwałe zniszczenie. Zostanie on rozłożony przez proteazę i chemikalia będą mogły być ponownie wykorzystane.
Niektóre substancje chemiczne mogą pomóc enzymowi w jeszcze lepszym wykonywaniu jego pracy. Są to tzw. aktywatory. Czasami substancja chemiczna może spowolnić działanie enzymu lub nawet sprawić, że enzym w ogóle nie będzie działał. Są to tzw. inhibitory. Większość leków to substancje chemiczne, które albo przyspieszają, albo spowalniają działanie jakiegoś enzymu w organizmie człowieka.

Amylaza ślinowa: jon chlorkowy zielony; wapń beżowy
Model z zamkiem i kluczem
Enzymy są bardzo specyficzne. W 1894 roku Emil Fischer zasugerował, że zarówno enzym jak i substrat mają specyficzne, komplementarne kształty geometryczne, które dokładnie do siebie pasują. Jest to często określane jako model "zamka i klucza". Jednak model ten nie wyjaśnia, co dzieje się później.W 1958 r. Daniel Koshland zaproponował modyfikację modelu zamka i klucza. Ponieważ enzymy są raczej elastycznymi strukturami, miejsce aktywne ulega przekształceniu w wyniku interakcji z substratem. W rezultacie substrat nie wiąże się po prostu do sztywnego miejsca aktywnego. Łańcuchy boczne aminokwasów w miejscu aktywnym są wyginane do pozycji, w których enzym wykonuje swoją pracę katalityczną. W niektórych przypadkach, takich jak glikozydazy, cząsteczka substratu również nieznacznie zmienia kształt, gdy wchodzi do miejsca aktywnego.
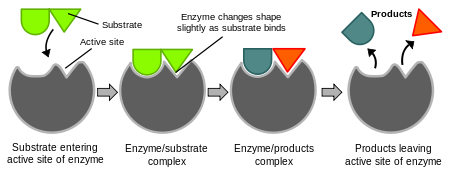
Schematy przedstawiające hipotezę indukowanego dopasowania działania enzymu
Model z zamkiem i kluczem
Enzymy są bardzo specyficzne. W 1894 roku Emil Fischer zasugerował, że zarówno enzym jak i substrat mają specyficzne, komplementarne kształty geometryczne, które dokładnie do siebie pasują. Jest to często określane jako model "zamka i klucza". Jednak model ten nie wyjaśnia, co dzieje się później.W 1958 r. Daniel Koshland zaproponował modyfikację modelu zamka i klucza. Ponieważ enzymy są raczej elastycznymi strukturami, miejsce aktywne ulega przekształceniu w wyniku interakcji z substratem. W rezultacie substrat nie wiąże się po prostu do sztywnego miejsca aktywnego. Łańcuchy boczne aminokwasów w miejscu aktywnym są wyginane do pozycji, w których enzym wykonuje swoją pracę katalityczną. W niektórych przypadkach, takich jak glikozydazy, cząsteczka substratu również nieznacznie zmienia kształt, gdy wchodzi do miejsca aktywnego.

Schematy przedstawiające hipotezę indukowanego dopasowania działania enzymu
Funkcja
Ogólne równanie reakcji enzymatycznej to:
Substrat + Enzym -> Substrat:Enzym -> Produkt:Enzym -> Produkt + Enzym
Enzymy obniżają energię aktywacji reakcji poprzez utworzenie kompleksu pośredniego z substratem. Kompleks ten nazywany jest kompleksem enzym-substrat.
Na przykład sacharoza, 400 razy większa od swojego substratu - sacharozy, rozszczepia sacharozę na cukry składowe, którymi są glukoza i fruktoza. Sacharoza wygina sacharozę i napina wiązania między glukozą i fruktozą. Cząsteczki wody przyłączają się i dokonują rozszczepienia w ułamku sekundy. Enzymy posiadają te kluczowe cechy:
- Są katalityczne. Powszechnie zwiększają szybkość reakcji 10 miliardów razy. p39 Sam enzym nie jest zmieniany przez reakcję.
- Są one skuteczne w małych ilościach. Jedna cząsteczka enzymu może przekształcić 1000 cząsteczek substratu w ciągu minuty, a niektóre są w stanie przekształcić 3 miliony w ciągu minuty. p39
- Są one wysoce specyficzne. Jeden enzym przeprowadzi tylko jedną z wielu reakcji, do których zdolny jest substrat.
Kontrola aktywności enzymów
Istnieje pięć głównych sposobów, w jaki aktywność enzymów jest kontrolowana w komórce.
- Produkcja enzymów (transkrypcja i translacja genów enzymów) może być zwiększona lub zmniejszona w odpowiedzi na zmiany w środowisku komórki. Ta forma regulacji genów nazywana jest indukcją i inhibicją enzymatyczną. Na przykład, u bakterii, które są odporne na antybiotyki takie jak penicylina, indukowane są enzymy, które hydrolizują cząsteczkę penicyliny.
- Enzymy mogą występować w różnych przedziałach komórkowych. Na przykład, kwasytłuszczowe są syntetyzowane przez jeden zestaw enzymów w cytozolu, retikulum endoplazmatycznym i aparacie Golgiego. Następnie są one wykorzystywane przez inny zestaw enzymów jako źródło energii w mitochondriach.
- Enzymy mogą być regulowane przez swoje własne produkty. Na przykład, produkt(y) końcowy(e) często hamuje(ją) jeden z pierwszych enzymów szlaku. Taki mechanizm regulacyjny nazywany jest ujemnym sprzężeniem zwrotnym, ponieważ ilość wytwarzanego produktu końcowego jest regulowana przez jego własne stężenie. Zapobiega to wytwarzaniu przez komórki zbyt dużej ilości enzymu. Kontrola działania enzymów pomaga w utrzymaniu stabilnego środowiska wewnętrznego w organizmach żywych.
- Enzymy mogą być regulowane poprzez modyfikację po ich wytworzeniu. Przykładem jest rozszczepienie łańcucha polipeptydowego. Chymotrypsyna, proteaza trawienna, jest produkowana w formie nieaktywnej w trzustce i w tej formie transportowana do żołądka, gdzie jest aktywowana. To powstrzymuje enzym przed trawieniem trzustki lub innych tkanek, zanim dostanie się do jelita. Ten rodzaj nieaktywnego prekursora enzymu znany jest jako zymogen.
- Niektóre enzymy mogą się aktywować, gdy zostaną przeniesione do innego środowiska (np. z wysokiego pH do niskiego pH). Na przykład, hemaglutynina w wirusie grypy jest aktywowana przez zmianę kształtu. Jest to spowodowane kwaśnymi warunkami, jakie panują wewnątrz lizosomu komórki gospodarza.
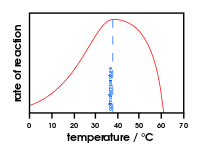
Wykres przedstawiający wpływ zmiany temperatury na aktywność enzymu
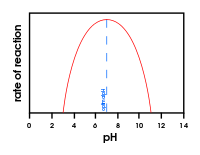
Wykres przedstawiający wpływ zmiany pH na aktywność enzymów
Funkcja
Ogólne równanie reakcji enzymatycznej to:
Substrat + Enzym -> Substrat:Enzym -> Produkt:Enzym -> Produkt + Enzym
Enzymy obniżają energię aktywacji reakcji poprzez utworzenie kompleksu pośredniego z substratem. Kompleks ten nazywany jest kompleksem enzym-substrat.
Na przykład sacharoza, 400 razy większa od swojego substratu - sacharozy, rozszczepia sacharozę na cukry składowe, którymi są glukoza i fruktoza. Sacharoza wygina sacharozę i napina wiązania między glukozą i fruktozą. Cząsteczki wody przyłączają się i dokonują rozszczepienia w ułamku sekundy. Enzymy posiadają te kluczowe cechy:
- Są katalityczne. Powszechnie zwiększają szybkość reakcji 10 miliardów razy. p39 Sam enzym nie jest zmieniany przez reakcję.
- Są one skuteczne w małych ilościach. Jedna cząsteczka enzymu może przekształcić 1000 cząsteczek substratu w ciągu minuty, a niektóre są w stanie przekształcić 3 miliony w ciągu minuty. p39
- Są one wysoce specyficzne. Jeden enzym przeprowadzi tylko jedną z wielu reakcji, do których zdolny jest substrat.
Kontrola aktywności enzymów
Istnieje pięć głównych sposobów, w jaki aktywność enzymów jest kontrolowana w komórce.
- Produkcja enzymów (transkrypcja i translacja genów enzymów) może być zwiększona lub zmniejszona w odpowiedzi na zmiany w środowisku komórki. Ta forma regulacji genów nazywana jest indukcją i inhibicją enzymatyczną. Na przykład, u bakterii, które są odporne na antybiotyki takie jak penicylina, indukowane są enzymy, które hydrolizują cząsteczkę penicyliny.
- Enzymy mogą występować w różnych przedziałach komórkowych. Na przykład, kwasy tłuszczowe są syntetyzowane przez jeden zestaw enzymów w cytozolu, retikulum endoplazmatycznym i aparacie Golgiego. Następnie są one wykorzystywane przez inny zestaw enzymów jako źródło energii w mitochondriach.
- Enzymy mogą być regulowane przez swoje własne produkty. Na przykład, produkt(y) końcowy(e) często hamuje(ją) jeden z pierwszych enzymów szlaku. Taki mechanizm regulacyjny nazywany jest ujemnym sprzężeniem zwrotnym, ponieważ ilość wytwarzanego produktu końcowego jest regulowana przez jego własne stężenie. Zapobiega to wytwarzaniu przez komórki zbyt dużej ilości enzymu. Kontrola działania enzymów pomaga w utrzymaniu stabilnego środowiska wewnętrznego w organizmach żywych.
- Enzymy mogą być regulowane poprzez modyfikację po ich wytworzeniu. Przykładem jest rozszczepienie łańcucha polipeptydowego. Chymotrypsyna, proteaza trawienna, jest produkowana w formie nieaktywnej w trzustce i w tej formie transportowana do żołądka, gdzie jest aktywowana. To powstrzymuje enzym przed trawieniem trzustki lub innych tkanek, zanim dostanie się do jelita. Ten rodzaj nieaktywnego prekursora enzymu znany jest jako zymogen.
- Niektóre enzymy mogą się aktywować, gdy zostaną przeniesione do innego środowiska (np. z wysokiego pH do niskiego pH). Na przykład, hemaglutynina w wirusie grypy jest aktywowana przez zmianę kształtu. Jest to spowodowane kwaśnymi warunkami, jakie panują wewnątrz lizosomu komórki gospodarza.

Wykres przedstawiający wpływ zmiany temperatury na aktywność enzymu

Wykres przedstawiający wpływ zmiany pH na aktywność enzymów
Inhibitory enzymów
Inhibitory mogą być stosowane w celu powstrzymania enzymu przed związaniem się z substratem. Można to zrobić w celu spowolnienia reakcji kontrolowanej przez enzym. Inhibitory pasują luźno lub częściowo do miejsca aktywnego enzymu. Zapobiega to lub spowalnia tworzenie się kompleksu enzym-substrat.
Inhibitory enzymów
Inhibitory mogą być stosowane w celu powstrzymania enzymu przed związaniem się z substratem. Można to zrobić w celu spowolnienia reakcji kontrolowanej przez enzym. Inhibitory pasują luźno lub częściowo do miejsca aktywnego enzymu. Zapobiega to lub spowalnia tworzenie się kompleksu enzym-substrat.
Denaturacja
Denaturacja to nieodwracalna zmiana miejsca aktywnego enzymu, spowodowana ekstremalną zmianą temperatury lub pH. Spowoduje to zmniejszenie szybkości reakcji, ponieważ cząsteczka substratu nie będzie w stanie zmieścić się w miejscu aktywnym, więc produkty nie będą mogły być tworzone.
Denaturacja
Denaturacja to nieodwracalna zmiana miejsca aktywnego enzymu, spowodowana ekstremalną zmianą temperatury lub pH. Spowoduje to zmniejszenie szybkości reakcji, ponieważ cząsteczka substratu nie będzie w stanie zmieścić się w miejscu aktywnym, więc produkty nie będą mogły być tworzone.
Kofaktory
Kofaktory lub koenzymy to cząsteczki pomocnicze, które są potrzebne do działania enzymów. Nie są one białkami i mogą być cząsteczkami organicznymi lub nieorganicznymi. Oba typy cząsteczek zawierają czasem w centrum jon metalu, taki jak Mg2+, Cu2+, Mn2+ lub klastry żelazowo-siarkowe. Dzieje się tak dlatego, że takie jony mogą działać jako donory elektronów, a to jest ważne w wielu reakcjach. Zapotrzebowanie enzymów na różnych małych pomocników jest podstawowym powodem, dla którego zwierzęta, w tym my sami, potrzebują mikroelementów i witamin.
Kofaktory
Kofaktory lub koenzymy to cząsteczki pomocnicze, które są potrzebne do działania enzymów. Nie są one białkami i mogą być cząsteczkami organicznymi lub nieorganicznymi. Oba typy cząsteczek zawierają czasem w centrum jon metalu, taki jak Mg2+, Cu2+, Mn2+ lub klastry żelazowo-siarkowe. Dzieje się tak dlatego, że takie jony mogą działać jako donory elektronów, a to jest ważne w wielu reakcjach. Zapotrzebowanie enzymów na różnych małych pomocników jest podstawowym powodem, dla którego zwierzęta, w tym my sami, potrzebują mikroelementów i witamin.
Klasyfikacja
Enzymy zostały sklasyfikowane przez Międzynarodową Unię Biochemii. Ich Komisja ds. Enzymów pogrupowała wszystkie znane enzymy w sześć klas:
- Oksydo-reduktazy: katalizują przenoszenie elektronów
- Transferazy: przenoszą grupę funkcyjną z jednej cząsteczki na drugą
- Hydrolazy: dodają grupę -OH (hydroksylową)
- Liazy: rozszczepiają wiązania chemiczne i często dodają wiązania podwójne lub strukturę pierścieniową
- Izomerazy: A -> B, gdzie B jest izomerem A
- Ligazy: łączą dwie duże cząsteczki: Ab + C -> A-C + b
Poszczególnym enzymom nadawany jest czterocyfrowy numer, który klasyfikuje je w bazie danych. p145
Klasyfikacja
Enzymy zostały sklasyfikowane przez Międzynarodową Unię Biochemii. Ich Komisja ds. Enzymów pogrupowała wszystkie znane enzymy w sześć klas:
- Oksydo-reduktazy: katalizują przenoszenie elektronów
- Transferazy: przenoszą grupę funkcyjną z jednej cząsteczki na drugą
- Hydrolazy: dodają grupę -OH (hydroksylową)
- Liazy: rozszczepiają wiązania chemiczne i często dodają wiązania podwójne lub strukturę pierścieniową
- Izomerazy: A -> B, gdzie B jest izomerem A
- Ligazy: łączą dwie duże cząsteczki: Ab + C -> A-C + b
Poszczególnym enzymom nadawany jest czterocyfrowy numer, który klasyfikuje je w bazie danych. p145
Zastosowania enzymów
Enzymy są wykorzystywane komercyjnie do:
- przygotowywanie żywności dla niemowląt - wstępne trawienie żywności dla niemowląt
- zmiękczanie środka czekolady
- biologiczny proszek do prania - zawierający enzymy proteazy, które rozkładają brud i zanieczyszczenia. Rozbija on duże, nierozpuszczalne cząsteczki na małe, rozpuszczalne cząsteczki. Działa w niższej temperaturze, więc potrzeba mniej energii (termostabilny).
Zastosowania enzymów
Enzymy są wykorzystywane komercyjnie do:
- przygotowywanie żywności dla niemowląt - wstępne trawienie żywności dla niemowląt
- zmiękczanie środka czekolady
- biologiczny proszek do prania - zawierający enzymy proteazy, które rozkładają brud i zanieczyszczenia. Rozbija on duże, nierozpuszczalne cząsteczki na małe, rozpuszczalne cząsteczki. Działa w niższej temperaturze, więc potrzeba mniej energii (termostabilny).
Powiązane strony
- Kinetyka wybuchów
Powiązane strony
- Kinetyka wybuchów
Pytania i odpowiedzi
P: Co to jest enzym?
O: Enzym to cząsteczka białka w komórkach, która działa jak biologiczny katalizator.
P: Jaką funkcję pełnią enzymy w organizmie?
O: Enzymy przyspieszają reakcje chemiczne w organizmie, ale nie zużywają się w tym procesie, więc mogą być wielokrotnie wykorzystywane.
P: Czy wszystkie reakcje biochemiczne w żywych organizmach wymagają enzymów?
O: Tak, prawie wszystkie reakcje biochemiczne w żywych organizmach wymagają enzymów.
P: Co to są substraty?
O: Substraty to substancje znajdujące się na początku reakcji.
P: Co to są produkty?
A: Produkty to substancje znajdujące się na końcu reakcji.
P: Jak nazywa się badanie enzymów?
A: Badanie enzymów nazywa się enzymologią.
P: Kto odkrył pierwszy enzym?
A: Pierwszy enzym został odkryty w 1833 roku przez Anselme Payena.
Przeszukaj encyklopedię