Reakcja chemiczna
Reakcja chemiczna ma miejsce, gdy jedna lub więcej substancji chemicznych zostaje zamieniona na jedną lub więcej innych. Przykłady:
- łączenie żelaza i tlenu w celu uzyskania rdzy
- ocet i soda oczyszczona łączone w celu uzyskania octanu sodu, dwutlenku węgla i wody
- rzeczy płonące lub wybuchające
- wiele reakcji, które zachodzą wewnątrz żywych rzeczy
- reakcje elektrochemiczne podczas rozładowywania lub ładowania akumulatorów
Niektóre reakcje są szybkie, a inne powolne. Niektóre z nich zachodzą z różną prędkością, w zależności od temperatury lub innych rzeczy. Na przykład, drewno nie reaguje z powietrzem, gdy jest zimne, ale gdy jest wystarczająco gorące, zaczyna się palić. Niektóre reakcje dają energię. Są to reakcje egzotermiczne. W innych reakcjach, energia jest pobierana. Są to reakcje endotermiczne.
Reakcje jądrowe nie są reakcjami chemicznymi. Reakcje chemiczne obejmują tylko elektrony atomów; reakcje jądrowe obejmują protony i neutrony w jądrach atomowych.

Rdzewiejąca żelazo

Ognisko jest przykładem dla redoxu.
Cztery podstawowe typy
Synteza
W reakcji syntezy dwie lub więcej prostych substancji łączą się, tworząc bardziej złożoną substancję.
A + B ⟶ A B {\i1}Styl A+B {\i1}wróbelka jasnowłosa AB}
"Dwa lub więcej reaktorów dających jeden produkt" to inny sposób na identyfikację reakcji syntezy. Jednym z przykładów reakcji syntezy jest połączenie żelaza i siarki w celu utworzenia siarczku żelaza(II):
8 F e + S 8 ⟶ 8 F e S {\i1} {\i1}Styl 8Fe+S_{\i0} {\i1}wróbelka 8FeS}
Innym przykładem jest prosty wodór gazowy w połączeniu z prostym gazem tlenowym w celu uzyskania bardziej złożonej substancji, takiej jak woda.
Dekompozycja
Reakcja rozkładu polega na rozpadnięciu się bardziej złożonej substancji na jej prostsze części. Jest to więc przeciwieństwo reakcji syntezy i można ją zapisać jako:
A B ⟶ A + B {\i1}styk AB {\i1}wróbelka jasnowłosa A+B}
Jednym z przykładów reakcji rozkładu jest elektroliza wody w celu uzyskania tlenu i wodoru:
2 H 2 O ⟶ 2 H 2 + O 2 {\i1}Styl 2H_{\i0}O {\i1}Styl 2H_{\i1}+O_{\i0}}
Pojedynczy zamiennik
W pojedynczej reakcji wymiany, pojedynczy niezłączony element zastępuje inny w związku; innymi słowy, jeden element handluje miejscami z innym elementem w związku Reakcje te występują w ogólnej formie:
A + B C ⟶ A C + B {\i1}Styl A+BC {\i0}wargonia jasnowłosa AC+B}
Jednym z przykładów pojedynczej reakcji wypornościowej jest zastąpienie wodoru w wodzie przez magnez w celu uzyskania wodorotlenku magnezu i wodoru gazowego:
M g + 2 H 2 O ⟶ M g ( O H ) 2 + H 2 {\i1}styk styropianu Mg+2H_{\i0}O\i1}Krwawnik biały Mg(OH)_{2}+H_{\i0}}
Podwójna wymiana
W reakcji podwójnego zamiennika, aniony i kationy dwóch związków zmieniają miejsca i tworzą dwa zupełnie różne związki. Reakcje te występują w formie ogólnej:
A B + C D ⟶ A D + C B {\i1}styk AB+CD {\i0}włókno jasne AD+CB}
Na przykład, gdy chlorek baru (BaCl2) i siarczan magnezu (MgSO4) reagują, SO42- anion przełącza się z 2Cl- anionem, dając związki BaSO4 i MgCl2.
Innym przykładem reakcji podwójnego przemieszczenia jest reakcja azotanu ołowiu(II) z jodkiem potasu, w wyniku której powstaje jodek ołowiu(II) i azotan potasu:
P b ( N O 3 ) 2 + 2 K I ⟶ P b I 2 + 2 K N O 3 {\i1} {\i1}styk styropianu Pb(NO_{3})_{2}+2KI {\i1}wróbelka jasnowłosa PbI_{2}+2KNO_{3}}
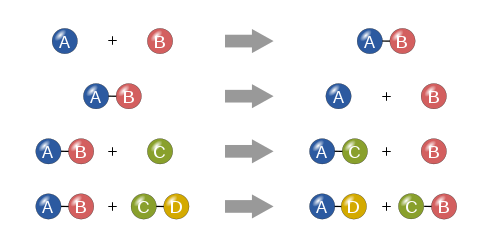
Cztery podstawowe typy reakcji chemicznych: synteza, rozkład, pojedyncze zastąpienie i podwójne zastąpienie
Równania
Reakcja chemiczna jest wyświetlana za pomocą równania:
A + B ⟶ C + D {\i1}styk styropianu {\i0}mathrm {\i1}A+B {\i1}wróbelka jasnowidzkiego C+D} }
Tutaj, A i B reagują na C i D w reakcji chemicznej.
Jest to przykład reakcji spalania.
C + O 2 ⟶ C O 2 {\i1} {\i1}displastyla {\i0}mathrm {C+O_{2} {\i1}longrightarrow CO_{2}} }
Powiązane strony
- Reakcja organiczna
- Redox
Pytania i odpowiedzi
P: Co to jest reakcja chemiczna?
O: Reakcja chemiczna zachodzi, gdy jedna lub więcej substancji chemicznych zmienia się w jedną lub więcej innych substancji chemicznych.
P: Czy może Pan podać przykłady reakcji chemicznych?
O: Tak, niektóre przykłady reakcji chemicznych to połączenie żelaza i tlenu w celu wytworzenia rdzy, połączenie octu i sody oczyszczonej w celu wytworzenia octanu sodu, dwutlenku węgla i wody, spalanie lub eksplozja rzeczy oraz wiele reakcji zachodzących wewnątrz organizmów żywych, takich jak fotosynteza.
P: Czy wszystkie reakcje chemiczne są szybkie?
O: Nie, niektóre reakcje są szybkie, a inne powolne. Niektóre przebiegają z różną prędkością, w zależności od temperatury lub innych czynników.
P: Co to jest reakcja egzotermiczna?
O: Reakcja egzotermiczna to reakcja, w której wydziela się energia.
P: Co to jest reakcja endotermiczna?
O: Reakcja endotermiczna to reakcja, która pochłania energię.
P: Czy reakcje jądrowe są uważane za reakcje chemiczne?
O: Nie, reakcje jądrowe nie są reakcjami chemicznymi. W reakcje chemiczne zaangażowane są tylko elektrony atomów, w reakcje jądrowe zaangażowane są protony i neutrony w jądrach atomowych.
P: Czy temperatura może mieć wpływ na szybkość reakcji chemicznej?
O: Tak, w zależności od temperatury lub innych czynników, niektóre reakcje mogą przebiegać z różną prędkością. Na przykład drewno nie reaguje z powietrzem, gdy jest zimne, ale jeżeli zostanie wystarczająco rozgrzane, zacznie się palić.
Przeszukaj encyklopedię









