pH — definicja, wzór i zakres skali kwasowości i zasadowości (0–14)
pH — definicja, wzór i skala 0–14. Poznaj, jak obliczać pH, co oznaczają wartości kwaśne i zasadowe oraz kiedy pH może przekroczyć zakres 0–14.
pH to skala określająca kwasowość lub zasadowość roztworu. Najczęściej przyjmuje się zakres od 0 do 14: roztwory bardziej kwaśne mają niższe pH, a roztwory zasadowe (alkaliczne) mają wyższe pH. Substancje obojętne (np. czysta woda w 25 °C) mają zazwyczaj pH równe 7. Kwasy mają pH poniżej 7, natomiast związki zasadowe mają pH większe niż 7.
Definicja i podstawowy wzór
pH jest miarą stężenia jonów wodoru (protonów, H+) w roztworze. Koncepcję pH wprowadził S.P.L. Sørensen w roku 1909. Skrót „p” pochodzi od niemieckiego potenz (moc, siła), a „H” oznacza jon wodorowy (H+).
Najczęściej podawanym wzorem jest:
pH = - log 10 [ H + ] {\i1} {\i1} {\i1}- {\i1}- {\i1}- log _{\i1}-left[{\i1}{\i1}^{\i1}- {\i1}left[{\i0}][mbox{\i0}] {\i1}
[H+] oznacza rzeczywiste stężenie jonów H+ (często zapisywane także jako [H3O+], ponieważ protony występują w roztworze związane z cząsteczkami wody jako jony hydroniowe). Stężenie to mierzy się w molach na litr (molarność, M).
Aktywność jonów a formalna definicja
Dokładniejsza definicja pH używa pojęcia aktywności jonów H+ (oznaczanej zwykle aH+), ponieważ w roztworach o dużym stężeniu jonów interakcje między jonami zmieniają efektywną „siłę” jonów:
pH = - log 10 [ a H + ] {\i1} {\i1} {\i1}- {\i1}-log _{\i1}left[a_{\i0} {\i1}mathrm {\i0}} {\i1}right]{\i0}
gdzie H + {\i1}wyraźny styl a_{\i0}mathrm {H^{\i0}}
Zakres skali i przykłady
Chociaż typowy zakres pH podawany w podręcznikach to 0–14 (wynika to z odwrotności logarytmicznej stężeń przy 25 °C, gdzie [H+][OH−] ≈ 10−14), w praktyce możliwe są wartości poniżej 0 i powyżej 14 w bardzo silnych i stężonych roztworach. Przykładowe wartości pH:
- sok żołądkowy ≈ 1–2,
- ocet (kwas octowy ~5% ) ≈ 2–3,
- woda dejonizowana w 25 °C ≈ 7 (obojętna),
- krew człowieka ≈ 7,35–7,45 (ściśle regulowane),
- woda morska ≈ 8,1,
- roztwór amoniaku domowego ≈ 11–12.
Pomiar pH
pH można mierzyć na kilka sposobów:
- elektronicznym pH-metrem (elektroda szklana) — najdokładniejsza metoda pomiaru pH laboratoryjnego i polowego,
- paskami wskaźnikowymi lub papierkiem wskaźnikowym — szybka orientacja, mniejsza dokładność,
- wskaźniki kolorymetryczne (np. uniwersalny wskaźnik, lakmus) — zmiana barwy w określonym zakresie pH,
- metody titracyjne — określanie pH przy znanym dodawaniu kwasu/zasady, przydatne przy określaniu stężeń i punktów równoważnikowych.
Znaczenie w chemii, biologii i przemyśle
pH wpływa na wiele procesów chemicznych i biologicznych: rozpuszczalność związków, szybkość reakcji, formę jonową substancji (np. dysocjację kwasów i zasad), aktywność enzymów, a także jakość wody i gleby. W biochemii pH roztworu określa jonizację grup funkcyjnych białek i wpływa na ich strukturę oraz funkcję — stąd istotne są buforowe układy utrzymujące stabilne pH (np. układ buforowy w krwi).
Bufory i pKa
Bufory to mieszaniny słabego kwasu i jego sprzężonej zasady (lub odwrotnie), które przeciwdziałają zmianom pH po dodaniu niewielkich ilości kwasu lub zasady. Właściwości buforu opisuje stała dysocjacji kwasu (pKa); największa skuteczność buforowa występuje w zakresie ±1 pH od pKa związku.
Uwagi praktyczne i bezpieczeństwo
Należy pamiętać, że stężone kwasy i zasady (zwłaszcza o bardzo niskim lub bardzo wysokim pH) są żrące i wymagają odpowiednich środków ochrony osobistej (okulary, rękawice, odzież ochronna). Przy pracy z takimi roztworami stosuje się też odpowiednie procedury rozcieńczania i neutralizacji.
Substancje alkaliczne mają, zamiast dominujących jonów wodorowych, wyższe stężenie jonów wodorotlenkowych (OH−), które determinują ich zasadowy charakter.
Wskaźniki pH
Niektóre barwniki zmieniają barwę w zależności od tego, czy znajdują się w roztworze kwaśnym, czy zasadowym. Wskaźnik pH jest związkiem chemicznym dodawanym w małych ilościach do roztworu, dzięki czemu można zobaczyć pH (kwasowość lub zasadowość) roztworu. Wskaźnik pH jest detektorem chemicznym jonów hydronowych (H3O+) lub jonów wodorowych (H+). Normalnie, wskaźnik powoduje zmianę barwy roztworu w zależności od pH.
Typowe wskaźniki to fenoloftaleina, pomarańcza metylowa, czerwień metylowa, błękit bromotymolowy i błękit tymolowy. Każdy z nich zmienia kolor w różnych punktach skali pH i może być stosowany razem jako uniwersalny wskaźnik.
Innym sposobem jest zastosowanie papieru lakmusowego, który oparty jest na naturalnych wskaźnikach pH. Papier może powiedzieć, jak silny jest środek chemiczny, czy jest to mocniejszy kwas, czy mocniejsza baza.
Niektóre popularne wartości pH
| pH | |
| Kwas akumulatorowy | 0 |
| Kwas żołądkowy | 1.0 |
| Sok cytrynowy | 2.4 |
| Cola | 2.5 |
| Woda natleniona | 2.5 - 3.0 |
| Ocet | 3.0 |
| Sok pomarańczowy lub jabłkowy | 3.0 |
| Piwo | 4.5 |
| Kawa | 5.0 |
| Mleko | 6.6 |
| 7.0 | |
| Krew | 7.35 - 7.45 |
| Szampon zwykły | 8.0 |
| Woda morska | 8.0 |
| Stała fala | 8.5 - 9.2 |
| Mydło ręczne | 9.0 - 10.0 |
| Farba do włosów | 9.5 - 10.5 |
| Magiczna prosta | 11.5 |
| Amoniak w gospodarstwie domowym | 11.5 |
| Bleach | 12.3 |
| Soda kaustyczna | 12.7 |
| ług domowy | 13.5 |
| Środek do czyszczenia odpływu | 14 |
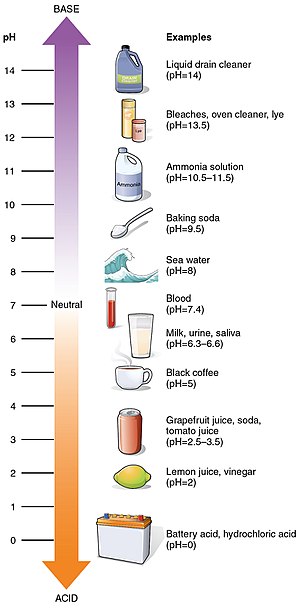
Wartości pH niektórych popularnych substancji
Neutralizacja
Neutralizacja może być podsumowana za pomocą równania:
H+
+ OH-
→ H
2O
Powiązane strony
Pytania i odpowiedzi
P: Co to jest pH?
O: pH to skala kwasowości od 0 do 14, która mierzy stężenie protonów (H+) w roztworze. Mówi o tym, jak kwaśna lub zasadowa jest dana substancja, przy czym roztwory bardziej kwaśne mają niższe pH, a bardziej zasadowe - wyższe. Roztwory neutralne mają zwykle pH 7.
P: Kto wprowadził pojęcie pH?
O: S.P.L. Sørensen wprowadził to pojęcie w 1909 roku.
Q: Co oznacza litera "p" w słowie "pH"?
O: Litera "p" oznacza niemieckie słowo potenz, czyli moc lub stężenie.
P: Jak oblicza się pH?
O: Najpopularniejszym wzorem do obliczenia pH jest logarytm ujemny z 10-krotnego stężenia jonów H+ (pisanych również jako [H3O+], co oznacza równe stężenie jonów hydroniowych) mierzonego w molach na litr (lub molarność). Istnieje jednak również równanie, które uwzględnia aktywność, a nie tylko stężenie, co w zależności od sytuacji może dać inne wartości niż bardziej powszechny wzór.
P: Jaki zakres ma większość substancji na skali pH?
O: Większość substancji ma pH pomiędzy 0 a 14, chociaż substancje skrajnie kwaśne lub zasadowe mogą mieć wartość poza tym zakresem (mniejszą niż 0 lub większą niż 14).
P: Czym różnią się substancje zasadowe od kwasowych w skali pH? O: Substancje zasadowe mają wyższe wartości na skali, ponieważ zawierają jony wodorotlenkowe (OH-), a nie jony wodorowe, jak kwasy.
Przeszukaj encyklopedię
![{\displaystyle {\mbox{pH}}=-\log _{10}\left[{\mbox{H}}^{+}\right]}](https://www.alegsaonline.com/image/093977a79b6a17e02db4699475930e48c05d6468.svg)
![{\displaystyle {\mbox{pH}}=-\log _{10}\left[a_{\mathrm {H^{+}} }\right]}](https://www.alegsaonline.com/image/7a631c4037415f3d4483a6cb07e69858b64890fc.svg)