Reakcja SN2
Reakcja SN2 (znana również jako bimolekularna substytucja nukleofilowa) jest reakcją substytucji w chemii organicznej. Jest to rodzaj substytucji nukleofilowej, w której samotna para z nukleofila atakuje centrum elektrofilowe z niedoborem elektronów i wiąże się z nim. Powoduje to usunięcie innej grupy zwanej "grupą odchodzącą". Tak więc, grupa wchodząca zastępuje grupę wychodzącą w jednym etapie. Ponieważ w powolnym, decydującym o szybkości reakcji etapie biorą udział dwa reagujące gatunki, stąd nazwa bimolekularna substytucja nukleofilowa lub SN2. Wśród chemików nieorganicznych, reakcja SN2 jest często znana jako mechanizm wymiany.
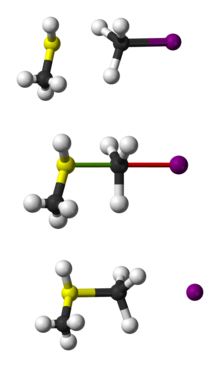
Przedstawienie reakcji SN2 CH3SH z CH3I w postaci kulki i patyczka.
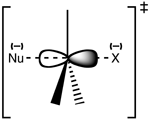
Struktura stanu przejściowego SN2
Mechanizm reakcji
Reakcja zachodzi najczęściej na alifatycznym centrum węglowym sp3 z przyłączoną do niego elektronegatywną, stabilną grupą opuszczającą - "X" - często atomem halogenku. Rozerwanie wiązania C-X i utworzenie nowego wiązania C-Nu zachodzi jednocześnie, tworząc stan przejściowy, w którym atakowany nukleofilowo węgiel jest pentakordynacyjny i w przybliżeniu zhybrydyzowany do sp2. Nukleofil atakuje węgiel pod kątem 180° w stosunku do grupy opuszczającej, ponieważ zapewnia to najlepsze nakładanie się samotnej pary nukleofila i orbitalu anty wiązania C-X σ*. Grupa opuszczająca jest następnie spychana na przeciwną stronę i powstaje produkt.
Jeśli atakowany nukleofilowo substrat jest chiralny, może to prowadzić, choć nie musi, do inwersji stereochemii, zwanej inwersją Waldena.
W przykładzie reakcji SN2, w wyniku ataku OH- (nukleofil) na bromoetan (elektrofil) powstaje etanol, a bromek zostaje wyrzucony jako grupa opuszczająca:
Reakcja SN2 zachodzi wtedy, gdy tylna droga ataku nie jest zablokowana przez inne atomy w cząsteczce (utrudniona sterycznie przez podstawniki na substracie). Tak więc mechanizm ten zachodzi zwykle przy niezablokowanym pierwotnym centrum węglowym. Jeśli w substracie w pobliżu grupy opuszczającej, np. w trzeciorzędowym centrum węglowym, występuje tłumienie steryczne, substytucja zachodzi raczej w mechanizmie SN1 niż SN2 (SN1 jest również bardziej prawdopodobne w przypadku zablokowanych cząsteczek, ponieważ może powstać wystarczająco stabilny pośrednik karbokationowy).
W chemii koordynacyjnej substytucja asocjacyjna przebiega według podobnego mechanizmu jak SN2.
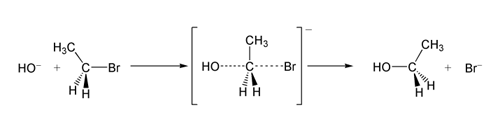
Reakcja SN2 bromoetanu z jonem wodorotlenkowym.
Czynniki wpływające na szybkość reakcji
Na szybkość reakcji wpływają cztery czynniki:
- Substrat. Substrat odgrywa najważniejszą rolę w określaniu szybkości reakcji. Dzieje się tak, ponieważ nukleofil atakuje od tylnej strony substratu, przerywając w ten sposób wiązanie węgiel - grupa opuszczająca i tworząc wiązanie węgiel - nukleofil. Dlatego, aby zmaksymalizować szybkość reakcji SN2, tylna część substratu musi być możliwie jak najmniej zakłócona. Ogólnie rzecz biorąc, oznacza to, że najszybciej reagują substraty metylowe i pierwszorzędowe, a następnie substraty drugorzędowe. Substraty trzeciorzędowe nie biorą udziału w reakcjach SN2 z powodu przeszkód sterycznych.
- Nukleofil. Podobnie jak w przypadku substratów, przeszkody steryczne wpływają na siłę nukleofila. Na przykład anion metoksydowy jest zarówno silną zasadą jak i nukleofilem, ponieważ jest nukleofilem metylowym, a więc jest w dużym stopniu pozbawiony przeszkód. Tert-butlenek, z drugiej strony, jest silną zasadą, ale słabym nukleofilem, ponieważ jego trzy grupy metylowe utrudniają mu zbliżenie się do węgla. Na siłę nukleofila wpływa również ładunek i elektronegatywność: nukleofilowość wzrasta wraz ze wzrostem ładunku ujemnego i zmniejszeniem elektronegatywności. Na przykład, OH- jest lepszym nukleofilem niż woda, a I- jest lepszym nukleofilem niż Br- (w polarnych rozpuszczalnikach protonowych). W polarnym rozpuszczalniku aprotycznym nukleofilowość wzrasta o kolumnę wyżej w układzie okresowym, ponieważ pomiędzy rozpuszczalnikiem a nukleofilem nie występuje wiązanie wodorowe. W tym przypadku nukleofilowość jest odzwierciedleniem zasadowości. I- byłby zatem słabszym nukleofilem niż Br-, ponieważ jest słabszą zasadą.
- Rozpuszczalnik. Rozpuszczalnik wpływa na szybkość reakcji, ponieważ rozpuszczalniki mogą otaczać lub nie otaczać nukleofil, utrudniając lub nie utrudniając jego podejście do atomu węgla. Polarne rozpuszczalniki aprotyczne, takie jak tetrahydrofuran, są lepszymi rozpuszczalnikami dla tej reakcji niż polarne rozpuszczalniki protetyczne, ponieważ polarne rozpuszczalniki protetyczne będą rozpuszczane przez rozpuszczalnik wiążący się wodorowo z nukleofilem. To utrudnia mu atak na węgiel z grupą opuszczającą.
- Grupa opuszczająca. Grupa opuszczająca wpływa na szybkość reakcji. Im bardziej stabilna jest grupa opuszczająca, tym większe prawdopodobieństwo, że zabierze ona dwa elektrony z wiązania grupy opuszczającej węgiel, gdy nukleofil zaatakuje węgiel. Dlatego też, im słabsza jest grupa opuszczająca jako zasada sprzężona, tym lepsza jest grupa opuszczająca. Podobnie, im silniejszy jest odpowiadający jej kwas, tym lepsza jest grupa opuszczająca. Przykładami dobrych grup opuszczających są halogenki (z wyjątkiem fluorków) i tosylany. Natomiast HO- i H2N- nie są dobrymi grupami opuszczającymi.
Kinetyka reakcji
Szybkość reakcji SN2 jest drugiego rzędu, ponieważ etap decydujący o szybkości zależy od stężenia nukleofila, [Nu-], jak również od stężenia substratu, [RX].
r = k[RX][Nu-]
Jest to kluczowa różnica pomiędzy mechanizmami SN1 i SN2. W reakcji SN1, nukleofil atakuje po zakończeniu etapu ograniczającego szybkość reakcji. Natomiast w reakcji SN2, nukleofil odrzuca grupę opuszczającą w etapie ograniczającym szybkość reakcji. Innymi słowy, szybkość reakcji SN1 zależy tylko od stężenia substratu, podczas gdy szybkość reakcji SN2 zależy od stężenia zarówno substratu, jak i nukleofila. W przypadkach, gdy możliwe są oba mechanizmy (np. przy drugorzędowym centrum węglowym), mechanizm zależy od rozpuszczalnika, temperatury, stężenia nukleofila lub od grupy opuszczającej.
Reakcje SN2 są generalnie preferowane w pierwszorzędowych halogenkach alkilowych lub drugorzędowych halogenkach alkilowych z rozpuszczalnikiem aprotycznym. W trzeciorzędowych halogenkach alkilowych zachodzą one ze znikomą szybkością z powodu przeszkód sterycznych.
SN2 i SN1 to dwie skrajne reakcje na ruchomej skali. Można znaleźć wiele reakcji, które w swoim mechanizmie wykazują zarówno charakter SN2 jak i SN1. Na przykład, możliwe jest otrzymanie kontaktowych par jonowych utworzonych z halogenków alkilowych, w których jony nie są w pełni rozdzielone. Kiedy ulegną one podstawieniu, stereochemia zostanie odwrócona (jak w SN2) dla wielu reagujących cząsteczek, ale kilka może wykazać zachowanie konfiguracji. Reakcje SN2 są bardziej powszechne niż reakcje SN1.
E2 konkurencja
Częstą reakcją uboczną zachodzącą w reakcjach SN2 jest eliminacja E2: wchodzący anion może działać jako zasada, a nie jako nukleofil, usuwając proton i prowadząc do powstania alkenu. Efekt ten można zademonstrować w reakcji w fazie gazowej pomiędzy sulfonianem i prostym bromkiem alkilowym zachodzącej wewnątrz spektrometru masowego:
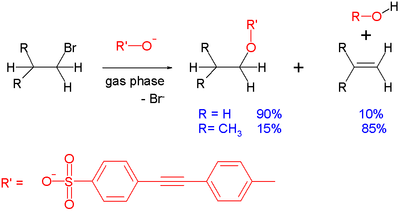
W przypadku bromku etylu, produktem reakcji jest głównie produkt substytucji. W miarę wzrostu przeszkód sterycznych wokół centrum elektrofilowego, tak jak w przypadku bromku izobutylu, substytucja jest niekorzystna i dominującą reakcją jest eliminacja. Innym czynnikiem sprzyjającym eliminacji jest siła zasady. W przypadku mniej zasadowego substratu benzoesanu, bromek izopropylu reaguje z 55% podstawieniem. Ogólnie rzecz biorąc, reakcje tego typu w fazie gazowej i w fazie roztworu wykazują te same tendencje, chociaż w tych pierwszych odpada wpływ rozpuszczalnika.
Mechanizm ronda
Odkrycie, które przyciągnęło uwagę w 2008 roku, dotyczy mechanizmu SN2 typu "roundabout" zaobserwowanego w reakcji w fazie gazowej pomiędzy jonami chlorkowymi i jodkiem metylu przy użyciu specjalnej techniki zwanej obrazowaniem skrzyżowanych wiązek molekularnych. Gdy jony chlorkowe mają wystarczającą prędkość, energia powstających jonów jodkowych po zderzeniu jest znacznie niższa niż oczekiwana, i teoretyzuje się, że energia jest tracona w wyniku pełnego okrążenia grupy metylowej wokół atomu jodu, zanim nastąpi faktyczne przemieszczenie.
Powiązane strony
- Reakcja substytucji
- Reakcja SN1
Pytania i odpowiedzi
P: Czym jest reakcja SN2?
O: Reakcja SN2 to reakcja substytucji w chemii organicznej, w której nukleofil atakuje centrum elektrofilowe z niedoborem elektronów, usuwając grupę opuszczającą, a następnie zastępując ją w jednym kroku.
P: Jakim rodzajem reakcji substytucji jest reakcja SN2?
O: Reakcja SN2 jest rodzajem reakcji substytucji nukleofilowej.
P: Ile reagujących gatunków bierze udział w powolnym, decydującym o szybkości etapie reakcji SN2?
O: Dwa reagujące gatunki są zaangażowane w powolny, determinujący szybkość etap reakcji SN2.
P: Jakie jest znaczenie nazwy "bimolekularna substytucja nukleofilowa" dla reakcji SN2?
O: Nazwa "dwucząsteczkowa substytucja nukleofilowa" dla reakcji SN2 odnosi się do faktu, że dwa reagujące gatunki są zaangażowane w powolny, decydujący o szybkości etap reakcji.
P: Czym jest nukleofil w kontekście reakcji SN2?
O: Nukleofil to cząsteczka lub jon, który oddaje samotną parę elektronów w celu utworzenia wiązania chemicznego.
P: Czym jest elektrofil w kontekście reakcji SN2?
O: Elektrofil to cząsteczka lub jon, który przyjmuje parę elektronów w celu utworzenia wiązania chemicznego.
P: Pod jaką nazwą reakcja SN2 jest często znana wśród chemików nieorganików?
O: Wśród chemików nieorganicznych reakcja SN2 jest często znana jako mechanizm wymiany.
Przeszukaj encyklopedię