Nukleofil
Nukleofil to gatunek, który oddaje parę elektronową elektrofilowi w celu utworzenia wiązania chemicznego w reakcji. Wszystkie cząsteczki lub jony posiadające wolną parę elektronów mogą być nukleofilami. Taka para elektronów nazywana jest parą samotną. Ponieważ nukleofile oddają elektrony, pasują one do definicji zasad Lewisa.
Nukleofilowość opisuje przyciąganie nukleofila do jąder atomowych. Nukleofilowość, czasami określana jako siła nukleofilu, odnosi się do nukleofilowego charakteru substancji i jest często używana do porównywania przyciągania atomów.
Neutralne reakcje nukleofilowe z rozpuszczalnikami takimi jak alkohole i woda nazywane są "solwolizą". Nukleofile mogą brać udział w reakcjach substytucji nukleofilowej. W tych reakcjach, nukleofil jest przyciągany przez pełny lub częściowy ładunek dodatni.
Historia
Terminy nukleofil i elektrofil zostały wprowadzone przez Christophera Kelka Ingolda w 1929 roku, zastępując terminy kationoid i anionoid zaproponowane wcześniej przez A. J. Lapwortha w 1925 roku.
Słowo nukleofil wywodzi się od nukleusa i greckiego słowa φιλος, philos oznaczającego miłość.
Właściwości
Ogólnie rzecz biorąc, w obrębie jednego rzędu układu okresowego, im bardziej zasadowy jon (im wyższe pKa sprzężonego kwasu), tym bardziej reaktywny jest jako nukleofil. W danej grupie polaryzowalność ma większe znaczenie w określaniu nukleofilowości. Innymi słowy, im łatwiej jest zniekształcić chmurę elektronową wokół atomu lub cząsteczki, tym chętniej będzie ona reagować. Na przykład, jon jodkowy (I-) jest bardziej nukleofilowy niż jon fluorkowy (F-).
Rodzaje nukleofili
Przykładami nukleofili są aniony, takie jak Cl-, lub związki z samotną parą elektronów, takie jak NH3 (amoniak).
W poniższym przykładzie, tlen jonu wodorotlenkowego oddaje parę elektronową, aby połączyć się z węglem na końcu cząsteczki bromopropanu. Wiązanie pomiędzy węglem a bromem ulega następnie heterolitycznemu rozszczepieniu, przy czym atom bromu przyjmuje oddany elektron i staje się jonem bromkowym (Br-). Jest to reakcjaSN2 zachodząca poprzez atak od tyłu. Oznacza to, że jon wodorotlenkowy atakuje atom węgla z drugiej strony, dokładnie naprzeciwko jonu bromu. Z powodu tego ataku od tyłu, reakcje SN2 prowadzą do odwrócenia konfiguracji elektrofilu. Jeśli elektrofil jest chiralny, to zazwyczaj zachowuje swoją chiralność, chociaż konfiguracja produktu SN2 jest odwrócona w porównaniu z konfiguracją oryginalnego elektrofilu (inwersja Waldena).
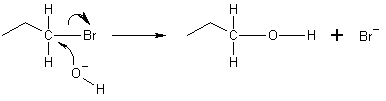
Nukleofil ambiwalentny to taki, który może atakować z dwóch lub więcej miejsc, dając w rezultacie dwa lub więcej produktów. Na przykład, jon tiocyjanianowy (SCN-) może atakować zarówno od strony S jak i N. Z tego powodu reakcjaSN2 halogenku alkilowego z SCN- często prowadzi do powstania mieszaniny RSCN (tiocyjanian alkilu) i RNCS (izotiocyjanian alkilu). Podobne mieszaniny będą występować w syntezie nitryli Kolbego.
Nukleofile węglowe
Halogenki metali alkilowych są nukleofilami węglowymi występującymi w reakcjach Grignarda, Blaise'a, Reformatsky'ego i Barbiera, odczynnikami organolitowymi oraz anionami terminalnych alkinów.
Enole są również nukleofilami węgla. Tworzenie się enolu jest katalizowane przez kwas lub zasadę. Enole są nukleofilami ambiwalentnymi, ale ogólnie rzecz biorąc, są nukleofilami przy atomie węgla obok węgli z wiązaniem podwójnym (atom węgla alfa). Enole są powszechnie stosowane w reakcjach kondensacji, w tym w reakcjach kondensacji Claisena i kondensacji aldolowej.
Nukleofile tlenowe
Przykładami nukleofilów tlenowych są woda (H2O), anion wodorotlenkowy, alkohole, aniony alkoksydowe, nadtlenek wodoru i aniony karboksylanowe.
Nukleofile siarkowe
Spośród nukleofili siarkowych najczęściej stosowane są: siarkowodór i jego sole, tiole (RSH), aniony tiolanowe (RS-), aniony kwasów tiolokarboksylowych (RC(O)-S-) oraz aniony ditiowęglanów (RO-C(S)-S-) i ditiokarbaminianów (R2N-C(S)-S-).
Ogólnie rzecz biorąc, siarka jest bardzo nukleofilowa ze względu na jej duży rozmiar, który sprawia, że jest łatwo polaryzowalna, a jej samotne pary elektronów są łatwo dostępne.
Nukleofile azotowe
Do nukleofili azotowych należą amoniak, azydek, aminy i azotyny.
Powiązane strony
- Elektrofil
- Baza Lewis
Pytania i odpowiedzi
P: Co to jest nukleofil?
O: Nukleofil to gatunek, który oddaje parę elektronową elektrofilowi w celu utworzenia wiązania chemicznego w reakcji.
P: Jakiego typu cząsteczki lub jony mogą być nukleofilami?
O: Wszystkie cząsteczki lub jony z wolną parą elektronów mogą być nukleofilami.
P: Jak nazywa się para elektronów oddawanych przez nukleofile?
O: Para elektronów nazywana jest samotną parą.
P: Do jakiej kategorii należą nukleofile?
O: Nukleofile należą do kategorii zasad Lewisa, ponieważ oddają elektrony.
P: Co opisuje termin "nukleofilowy"?
O: Termin "nukleofilowy" opisuje przyciąganie nukleofila do jądra.
Q: Do czego odnosi się termin "nukleofilowość"?
O: Termin "nukleofilowość" odnosi się do nukleofilowego charakteru substancji i jest często używany do porównywania przyciągania atomów.
P: Czym są reakcje "solwolizy"?
O: Neutralne reakcje nukleofilowe z rozpuszczalnikami, takimi jak alkohole i woda, nazywane są "solwolizą".
Przeszukaj encyklopedię