Układ okresowy pierwiastków — definicja, tabela i właściwości
Kompletny przewodnik po układzie okresowym pierwiastków: definicja, tabela, grupy, okresy, właściwości i historia Mendelejewa — zrozum, jak działają pierwiastki.
Układ okresowy pierwiastków chemicznych jest uporządkowanym wykazem znanych pierwiastków chemicznych. W tabeli pierwiastki umieszczone są w kolejności ich liczb atomowych, zaczynając od najmniejszej (1 — wodór). Liczba atomowa pierwiastka odpowiada liczbie protonów w jego jądrze atomu i jednoznacznie identyfikuje dany pierwiastek. W układzie okresowym pierwiastki są ułożone w okresy i grupy. Rząd pierwiastków w poprzek tabeli nazywamy okresem. Każdy okres ma numer od 1 do 7. Okres 1 zawiera tylko 2 pierwiastki: wodór i hel. Okresy 2 i 3 mają po 8 pierwiastków, okresy 4 i 5 po 18, a okresy 6 i 7 po 32 (wliczając bloki f — lantanoidy i aktynoidy). Pierwiastki w danym okresie mają kolejne liczby atomowe i stopniowo zmieniają się ich właściwości fizyczne i chemiczne wraz ze wzrostem liczby atomowej.
Grupy i ich znaczenie
Kolumna pierwiastków biegnąca w dół tabeli nazywana jest grupą. W standardowej tablicy okresowej jest 18 grup; każda ma numer od 1 do 18. Pierwiastki należące do tej samej grupy mają podobne konfiguracje elektronów zewnętrznych i zbliżoną liczbę elektronów walencyjnych, co przekłada się na podobne właściwości chemiczne. Przykłady istotnych grup:
- Grupa 1 — metale alkaliczne (np. cez), bardzo reaktywne metalicznie;
- Grupa 2 — metale ziem alkalicznych;
- Grupa 17 — halogeny, silnie reaktywne niemetale;
- Grupa 18 — gazy szlachetne (np. hel), charakteryzujące się niską reaktywnością; niektóre z nich (zwłaszcza cięższe jak ksenon) mogą jednak tworzyć związki.
Systemy numeracji grup
Istniały różne systemy numeracji grup. Jeden używał cyfr rzymskich, inne arabskich. W 1990 roku Międzynarodowa Unia Chemii Czystej i Stosowanej (IUPAC) przyjęła system arabskich numerów (1–18), aby ujednolicić oznaczenia stosowane przez naukowców na świecie.
Podział na metale, niemetale i metaloidy
W układzie okresowym wyróżnia się trzy główne kategorie pierwiastków: metale, metaloidy i niemetale. Ogólne tendencje są następujące:
- Elementy po lewej stronie i w dolnej części tablicy są zazwyczaj najbardziej metaliczne (łatwo oddają elektrony) — np. cez.
- Elementy po prawej górze są najmniej metaliczne (mają tendencję do przyjmowania elektronów) — np. hel jako gaz szlachetny; inne niemetale to tlen, fluor czy azot.
- Między metalami a niemetalami leżą metaloidy, które wykazują mieszane właściwości.
Trendy okresowe i właściwości
Układ okresowy służy chemikom do obserwowania wzorców i zależności między pierwiastkami. Do najważniejszych trendów należą:
- Promień atomowy: generalnie rośnie w dół grupy i maleje wzdłuż okresu z lewej do prawej;
- Energia jonizacji: czyli energia potrzebna do usunięcia elektronu, zwykle rośnie w okresie z lewej na prawo i maleje w dół grupy;
- Elektroujemność: wzrasta w okresie z lewej na prawo i maleje w dół grupy (skala Paulinga opisuje tę wielkość);
- Stopnie utlenienia i typowe związki: pierwiastki z tej samej grupy często tworzą podobne typy jonów i związków;
- Bloki elektronowe (s, p, d, f) odzwierciedlają, które orbitale są zapełniane i wpływają na chemiczne zachowanie pierwiastków.
Bloki układu okresowego
W układzie okresowym wyróżnia się bloki związane z typem zapełnianych orbitali:
- Blok s — grupy 1–2 (metale alkaliczne i ziem alkalicznych) oraz wodór i hel;
- Blok p — grupy 13–18 (zawiera wiele niemetali i metali lekkich);
- Blok d — przejściowe metale (grupy 3–12);
- Blok f — lantanoidy i aktynoidy, zwykle umieszczane pod główną tabelą.
Historia i wkład Mendelejewa
Układ okresowy został ukształtowany i spopularyzowany przez rosyjskiego chemika Dymitra IwanowiczaMendelejewa (1834-1907). Mendelejew ułożył pierwiastki według mas atomowych i przewidywał istnienie oraz właściwości jeszcze nieodkrytych pierwiastków, co później potwierdziły odkrycia. Na jego cześć nazwano pierwiastek o liczbie atomowej 101 — mendelewium.
Układ okresowy nadal ewoluuje: co pewien czas potwierdzane są nowe pierwiastki syntetyczne (szczególnie w ciężkich liczbach atomowych), a badania nad własnościami i zastosowaniami pierwiastków stale poszerzają naszą wiedzę. Dzięki tabeli okresowej naukowcy potrafią przewidywać reakcje chemiczne, projektować nowe związki i materiały oraz zrozumieć zależności między strukturą atomową a właściwościami makroskopowymi.
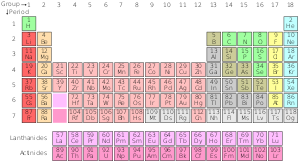
Standardowa odmiana układu okresowego
Standardowy układ okresowy
| Grupa → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 13 | 14 | 15 | 16 | 17 | ||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * Lantanowce | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 87 Fr | 88 | ** Aktynowce | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 Uue | 120 Ubn | *** Superaktynidy | |||||||||||||||||
| * Lanthanide Series | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Seria Actinide | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Seria Superactinide | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Seria Superactinide | 136Uth | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Seria Superactinide | 151Upu | 152Upb | 153Upt | 154Upq | 155Upp | 156Uph | 157Ups | 158Upo | 159Upa | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165Uhp | |||||
| *** Seria Superactinide | 166Uhh | 167Uhs | 168Uho | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Użytek | 180Uon | |||||
| *** Seria Superactinide | 181Uou | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Seria Superactinide | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Seria Superactinide | 211Buu | 212Bub | 213But | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220Bbn | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bbp | |||||
Seria chemiczna tabeli okresowej
- Metale alkaliczne
- Ziemia alkaliczna
- Lantanowce
- Aktynowce
- Superaktynidy
- Metale przejściowe
- Biedne metale
- Niemetale
- Halogeny
Stan w standardowej temperaturze i ciśnieniu. Kolor liczby (liczby atomowej) nad symbolem elementu pokazuje stan elementu w normalnych warunkach.
- te w kolorze niebieskim to gazy
- te w kolorze zielonym to ciecze
- te w kolorze czarnym są solidne
- Osoby o stałych granicach mają stabilne izotopy (pierwiastki pierwotne)
- Te z przerywanymi granicami mają tylko radioaktywne, naturalnie występujące izotopy
- Te z kropkowanymi granicami nie występują w sposób naturalny (elementy syntetyczne)
- ci bez granic są zbyt radioaktywni, by można było ich jeszcze odkryć.
Inne metody wyświetlania pierwiastków chemicznych
Przedstawiona powyżej wersja układu okresowego jest najczęściej stosowaną wersją. Inne szeroko rozpowszechnione wersje zostały przedstawione poniżej:
· 
Theodor Benfey ułożył pierwiastki w spiralę, wokół wodoru. Masa atomowa decyduje o położeniu pierwiastka.
· 
Dmitrij Iwanowicz Mendelejew użył aranżacji kwiatowej; aktynowce, lantanowce są pokazane jako pętle obok głównej grupy.
· 
Piec Timothy'ego ułożył elementy według liczby kwantowej.
· ![]()
Betterman ułożył elementy według ich właściwości izoelektrycznych, które mogą być przekształcone w formę wielomianu.
· 
Wersja trójkątna, autorstwa Zmaczyńskiego i Bayleya
· 
Ułożone w piramidzie.
Wersje używane mniej
- W standardowej tabeli znajdują się podstawowe informacje. Jest ona pokazana powyżej
- Pionowa tabela zapewniająca lepszą czytelność w przeglądarkach internetowych
- Duża tabela zawiera podstawy oraz pełne nazwy elementów.
- Ogromna tabela zawiera podstawy oraz pełne nazwy elementów i masy atomowe.
- Konfiguracje elektronów
- Metale i metale nieżelazne
- Lista elementów: zawiera nazwę, symbol, liczbę atomową, masę atomową, grupę i okres; może być posortowana według dowolnej z tych grup
- Lista elementów według symboli
- Wykaz elementów według temperatury wrzenia
- Wykaz elementów według temperatury topnienia
- Wykaz elementów według gęstości
Powiązane strony
- Grupa tabeli okresowej
- Okres objęty tabelą okresową
- Rozszerzony układ okresowy
Pytania i odpowiedzi
P: Co to jest układ okresowy?
O: Układ okresowy to tabela, która porządkuje wszystkie znane pierwiastki chemiczne w kolejności ich liczb atomowych, zaczynając od wodoru na pierwszym miejscu. Pierwiastki o podobnych cechach są często umieszczane obok siebie.
P: Ile jest okresów i grup w standardowym układzie okresowym?
O: W standardowym układzie okresowym jest 8 okresów i 18 grup.
P: Co mają wspólnego pierwiastki w jednym okresie?
O: Pierwiastki w okresie mają kolejne liczby atomowe.
P: Co mają wspólnego pierwiastki w grupie?
O: Pierwiastki w grupie mają elektrony ułożone podobnie, zgodnie z liczbą elektronów walencyjnych, co daje im podobne właściwości chemiczne.
P: Kto wymyślił układ okresowy?
A: Układ okresowy wynalazł rosyjski chemik Dmitrij Iwanowicz Mendelejew (1834-1907).
P: Jakie są trzy główne grupy na tablicy okresowej?
O: Trzy główne grupy w układzie okresowym to metale, metaloidy i niemetale.
P: W jaki sposób można zaobserwować wzory i związki między pierwiastkami za pomocą układu okresowego?
O: Wzorce i zależności między pierwiastkami można zaobserwować, patrząc na ich miejsce w Układzie Okresowym; na przykład, pierwiastki znajdujące się na dole po lewej stronie są bardziej metaliczne niż te na górze po prawej.
Przeszukaj encyklopedię