Karbokation
Karbokation to jon z dodatnio naładowanym atomem węgla. Naładowany atom węgla w karbokationie jest "sekstetem" (to znaczy, że ma tylko sześć elektronów w zewnętrznej powłoce walencyjnej zamiast ośmiu elektronów walencyjnych). Atomy węgla z ośmioma wyborami walencyjnymi mają maksymalną stabilność (reguła oktetu). Dlatego karbokationy są często reaktywne, dążąc do wypełnienia oktetu elektronów walencyjnych, jak również do odzyskania neutralnego ładunku. Logika podpowiada, że karbokationy mają hybrydyzację sp3, a pusty orbital sp3 daje ładunek dodatni. Jednakże, reaktywność karbokationu bardziej przypomina hybrydyzację sp2 z geometrią cząsteczki w planie trygonalnym.
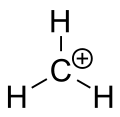
Jon karbenowy metanu

kation tert-butylowy, wykazujący geometrię planarną
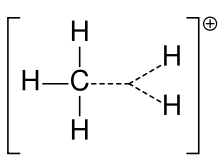
Jon węglowy metanu
Definicje
Karbokation był wcześniej często nazywany jonem węglowym, ale chemicy kwestionują jego dokładne znaczenie. W dzisiejszej chemii karbokationem jest każdy dodatnio naładowany atom węgla. Zasugerowano dwa specjalne typy: jony karbenowe są trójwartościowe, a jony węglowe są pięcio- lub sześciowartościowe. Podręczniki na poziomie uniwersyteckim omawiają karbokationy tylko tak, jakby były to jony karbenowe, lub omawiają karbokationy z przelotnym odniesieniem do starszego sformułowania jon karbenowy lub jony karbenowe i karbonowe. Jeden z podręczników do dnia dzisiejszego pozostaje przy starszej nazwie jonu węglowego dla jonu karbenowego i rezerwuje zwrot hiperwartościowy jon karbenowy dla CH5+.
Historia
W 1891 r. G. Merling poinformował, że dodał brom do tropylidenu (cykloheptatryny), a następnie podgrzał produkt, aby otrzymać krystaliczny, rozpuszczalny w wodzie materiał, C
7H
7Br. Nie zaproponował jego struktury, jednak Doering i Knox przekonująco wykazali, że jest to bromek tropylium (cykloheptatrienylium). Przewiduje się, że jon ten jest aromatyczny zgodnie z regułą Hückela.
W 1902 roku Norris i Kehrman niezależnie odkryli, że bezbarwny trifenylometanol daje głęboko żółte roztwory w stężonym kwasie siarkowym. Chlorek trifenylometylowy podobnie tworzył pomarańczowe kompleksy z chlorkami glinu i cyny. W 1902 r. Adolf von Baeyer rozpoznał solny charakter powstałych związków.

Zależność między kolorem a tworzeniem się soli nazwał halochromią, której doskonałym przykładem jest zieleń malachitowa.
Karbokationy są reaktywnymi intermediatami w wielu reakcjach organicznych. Idea ta, po raz pierwszy zaproponowana przez Juliusa Stieglitza w 1899 r., została rozwinięta przez Hansa Meerweina w jego badaniach z 1922 r. nad rearanżacją Wagnera-Meerweina. Stwierdzono również, że karbokationy biorą udział w reakcjiSN1, reakcji E1 oraz w reakcjach rearanżacji, takich jak przesunięcie Whitmore'a 1,2. Chemiczny establishment niechętnie akceptował pojęcie karbokacji i przez długi czas Journal of the American Chemical Society odrzucał artykuły, w których o nich wspominano.
Pierwsze widmo NMR stabilnej karbokationu w roztworze zostało opublikowane przez Doeringa i wsp. w 1958 roku. Był to jon heptametylobenzenoniowy, otrzymany w wyniku reakcji heksametylobenzenu z chlorkiem metylu i chlorkiem glinu. Stabilny kation 7-norbornadienylowy został otrzymany przez Story i wsp. w 1960 r. w reakcji chlorku norbornadienylowego z tetrafluoroboranem srebra w dwutlenku siarki w temperaturze -80 °C. Widmo NMR wykazało, że był to jon nieklasycznie zmostkowany (pierwszy zaobserwowany stabilny jon nieklasyczny).
W 1962 r. Olah bezpośrednio zaobserwował karbokation tert-butylowy za pomocą magnetycznego rezonansu jądrowego jako stabilny gatunek podczas rozpuszczania fluorku tert-butylu w kwasie magnezowym. NMR kationu norbornylu został po raz pierwszy opisany przez Schleyera et al. i wykazano, że ulega on protonowemu skramblingowi przez barierę przez Saundersa et al.
Właściwości
W chemii organicznej, karbokationy są często celem ataku nukleofilowego nukleofili, takich jak jony hydroksylowe (OH-) lub jony halogenowe.
Karbokationy są klasyfikowane jako pierwszorzędowe, drugorzędowe lub trzeciorzędowe w zależności od liczby atomów węgla związanych z węglem zjonizowanym. Karbokationy pierwszorzędowe mają jeden lub zero węgli przyłączonych do zjonizowanego węgla, karbokationy drugorzędowe mają dwa węgle przyłączone do zjonizowanego węgla, a karbokationy trzeciorzędowe mają trzy węgle przyłączone do zjonizowanego węgla.
Stabilność karbokationu wzrasta wraz z liczbą grup alkilowych przyłączonych do węgla przenoszącego ładunek. Karbokationy trzeciorzędowe są bardziej stabilne (i łatwiej się tworzą) niż karbokationy drugorzędowe; karbokationy pierwszorzędowe są bardzo niestabilne, ponieważ podczas gdy zjonizowane węgle wyższego rzędu są stabilizowane przez hiperkoniugację, niepodstawione (pierwszorzędowe) węgle nie są. Dlatego też reakcje takie jak reakcja SN1 i reakcja eliminacji E1 zwykle nie zachodzą, jeśli miałby powstać karbokation pierwszorzędowy. Wyjątkiem jest sytuacja, gdy obok zjonizowanego węgla znajduje się wiązanie podwójne węgiel-węgiel. Takie kationy jak kation allilowy CH2=CH-CH2+ i kation benzylowy C6H5-CH2+ są bardziej stabilne niż większość innych karbokationów. Cząsteczki, które mogą tworzyć karbokationy allilowe lub benzylowe są szczególnie reaktywne.
Karbokationy ulegają reakcjom rearanżacji z mniej stabilnych struktur do równie stabilnych lub bardziej stabilnych ze stałymi szybkości przekraczającymi 109/s. Fakt ten komplikuje drogę syntezy wielu związków. Na przykład, gdy 3-pentanol jest ogrzewany z wodnym HCl, początkowo utworzona 3-pentylowa karbokationacja rearanżuje się do statystycznej mieszaniny 3-pentylowej i 2-pentylowej. Kationy te reagują z jonem chlorkowym, tworząc około 1/3 3-chloropentanu i 2/3 2-chloropentanu.
Niektóre karbokationy, takie jak kation norbornylu, wykazują mniej lub bardziej symetryczne wiązanie trójcentrowe. Kationy tego rodzaju określa się mianem jonów nieklasycznych. Różnica energetyczna pomiędzy "klasycznymi" karbokationami a "nieklasycznymi" izomerami jest często bardzo mała, a energia aktywacji związana z przejściem pomiędzy strukturami "klasycznymi" i "nieklasycznymi" jest zazwyczaj niewielka, jeśli w ogóle występuje. Nieklasyczna" forma karbokationu 2-butylowego jest w istocie 2-butenem z protonem bezpośrednio powyżej centrum wiązania podwójnego węgiel-węgiel. "Nieklasyczne" karbokationy były kiedyś przedmiotem wielkich kontrowersji. Jednym z największych wkładów George'a Olah'a do chemii było rozwiązanie tej kontrowersji.
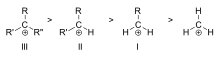
Kolejność według stabilności przykładów karbokationów alkilowych trzeciorzędowych (III), drugorzędowych (II) i pierwszorzędowych (I)
Karbokationy właściwe
Kationy cyklopropylokarbinylowe mogą być badane metodą NMR:

W widmie NMR pochodnej dimetylowej występują dwa nierównoważne sygnały dla dwóch grup metylowych wskazujące, że konformacja molekularna tego kationu nie jest prostopadła (jak w A), lecz dwupłaszczyznowa (jak w B) z pustym orbitalem p i układem pierścienia cyklopropylowego w tej samej płaszczyźnie:

Z punktu widzenia teorii wiązań ugiętych, preferencja ta jest wyjaśniona przez założenie korzystnego nakładania się orbitali pomiędzy wypełnionymi wiązaniami ugiętymi cyklopropanu i pustym orbitalem p.
Pytania i odpowiedzi
P: Co to jest karbokracja?
A: Karbokracja to jon z dodatnio naładowanym atomem węgla.
P: Co to jest zewnętrzna powłoka walencyjna karbokationu?
A: Zewnętrzna powłoka karbokationu ma tylko sześć elektronów zamiast stabilnych ośmiu elektronów walencyjnych.
P: Dlaczego karbokationy są często reaktywne?
O: Karbokationy są często reaktywne, ponieważ starają się wypełnić oktet elektronów walencyjnych i odzyskać neutralny ładunek.
P: Jaka jest maksymalna stabilność atomów węgla?
O: Maksymalna stabilność atomów węgla jest osiągana, gdy mają one osiem elektronów walencyjnych.
P: Co to jest sekstet w chemii?
A: Sekstet to termin używany do opisania atomu węgla w karboksie, który ma tylko sześć elektronów w swojej zewnętrznej powłoce walencyjnej zamiast stabilnych ośmiu elektronów walencyjnych.
P: Jaka jest hybrydyzacja i geometria molekularna karbokationu?
O: Chociaż logika sugerowałaby, że karbokationy mają hybrydyzację sp3 z pustym orbitalem sp3 dającym ładunek dodatni, ich reaktywność bardziej przypomina hybrydyzację sp2 z trójkątną geometrią molekularną.
P: Co to jest reguła oktetu?
O: Reguła oktetu to zasada w chemii, która mówi, że atomy mają tendencję do tworzenia wiązań chemicznych z innymi atomami, które umożliwiają obu atomom posiadanie stabilnego zestawu ośmiu elektronów walencyjnych.
Przeszukaj encyklopedię