Węglowodory aromatyczne
Węglowodór aromatyczny, inaczej arena, jest związkiem węglowodorowym o budowie pierścieniowej. Posiada naprzemienne podwójne i pojedyncze wiązania pomiędzy atomami węgla tworzącymi pierścienie. Wiele z tych związków ma słodki zapach, stąd określenie "aromatyczny". Pierścień składający się z sześciu atomów węgla w związkach aromatycznych nazywany jest pierścieniem benzenowym, od najprostszego możliwego pierścienia węglowodorowego, benzenu. Węglowodory aromatyczne mogą być monocykliczne (MAH) lub policykliczne (PAH).
Niektóre związki niebenzenowe zwane heteroarenami, które spełniają regułę Hückla, są również związkami aromatycznymi. W związkach tych co najmniej jeden atom węgla jest zastąpiony jednym z atomów tlenu, azotu lub siarki.
Model pierścienia benzenowego
Benzen, C6H6, jest najprostszym węglowodorem aromatycznym i został uznany za pierwszy węglowodór aromatyczny, a charakter jego wiązań został po raz pierwszy rozpoznany przez Kekulégo w XIX wieku. Każdy atom węgla w cyklu heksagonalnym ma cztery elektrony, którymi może się dzielić. Jeden idzie do atomu wodoru, a po jednym do dwóch sąsiednich węgli. Pozostaje jeden elektron do podziału z jednym z dwóch sąsiednich atomów węgla, dlatego cząsteczka benzenu jest narysowana z naprzemiennymi wiązaniami pojedynczymi i podwójnymi wokół sześciokąta.
Struktura jest również zilustrowana jako okrąg wokół wnętrza pierścienia, aby pokazać sześć elektronów pływających wokół w delokalizowanych orbitalach molekularnych o wielkości samego pierścienia. To również reprezentuje równoważną naturę sześciu wiązań węgiel-węgiel, z których każdy jest równoważny ~1.5. Elektrony są wizualizowane jako pływające powyżej i poniżej pierścienia z pól elektromagnetycznych, które generują działając, aby utrzymać pierścień płasko.
Ogólne właściwości:
- Pokaż aromatyczność.
- Stosunek węgla do wodoru jest wysoki.
- Ze względu na wysoki stosunek węgla do wodoru palą się one żółtym, słonawym płomieniem.
- Ulegają one reakcjom substytucji.
Symbol okręgu dla aromatyczności został wprowadzony przez Sir Roberta Robinsona i jego ucznia Jamesa Armita w 1925 roku i spopularyzowany począwszy od 1959 roku przez podręcznik chemii organicznej Morrison & Boyd. Właściwe użycie tego symbolu jest dyskutowane; w niektórych publikacjach jest on używany do opisania każdego cyklicznego systemu pi, a w innych tylko tych systemów pi, które są zgodne z regułą Hückela.
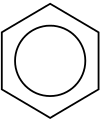
Benzen
Synteza areny
Reakcja, która tworzy związek arenowy z nienasyconego lub częściowo nienasyconego prekursora cyklicznego jest nazywana po prostu aromatyzacją. Istnieje wiele metod laboratoryjnych do organicznej syntezy arenów z prekursorów niearenowych.
Znaczenie związków aromatycznych
Związki aromatyczne odgrywają kluczową rolę w biochemii wszystkich żywych organizmów. Cztery aromatyczne aminokwasy: histydyna, fenyloalanina, tryptofan i tyrozyna, każdy z nich służy jako jeden z 20 podstawowych budulców białek. Ponadto wszystkie 5 nukleotydów (adenina, tymina, cytozyna, guanina i uracyl), które tworzą sekwencję kodu genetycznego w DNA i RNA, to aromatyczne puryny lub pirymidyny. Ponadto, cząsteczka hemu zawiera układ aromatyczny z 22 elektronami π. Chlorofil również posiada podobny układ aromatyczny.
Związki aromatyczne mają duże znaczenie w przemyśle. Główne węglowodory aromatyczne o znaczeniu handlowym to benzen, toluen, orto-ksylen i para-ksylen. Każdego roku na świecie produkuje się ich około 35 milionów ton. Są one ekstrahowane ze złożonych mieszanin otrzymywanych w procesie rafinacji ropy naftowej lub destylacji smoły węglowej. Wykorzystuje się je do produkcji szeregu ważnych chemikaliów i polimerów, w tym styrenu, fenolu, aniliny, poliestru i nylonu.
Rodzaje związków aromatycznych
Prawie wszystkie związki aromatyczne są związkami węgla, ale nie muszą to być węglowodory.
Heterocykliczne
W aromatycznych związkach heterocyklicznych jeden lub więcej atomów w pierścieniu aromatycznym jest z pierwiastka innego niż węgiel. Przykładami są pirydyna, pirazyna, imidazol, pirazol, oksazol i tiofen.
Wielopierścienie
Wielopierścieniowe węglowodory aromatyczne to cząsteczki z dwoma lub więcej prostymi pierścieniami aromatycznymi połączonymi ze sobą poprzez współdzielenie dwóch sąsiadujących atomów węgla. Przykładami są naftalen, antracen i fenantren.
Podstawione węglowodory aromatyczne
Wiele związków chemicznych to pierścienie aromatyczne z dołączonymi innymi elementami. Przykłady obejmują trinitrotoluen (TNT), kwas acetylosalicylowy (aspiryna), paracetamol i nukleotydy DNA.
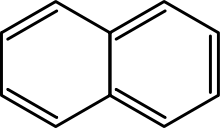
Nathlalene ma dwa pierścienie.
Pytania i odpowiedzi
P: Co to jest węglowodór aromatyczny?
A: Aromatyczny węglowodór to pierścieniowy związek węglowodorowy z naprzemiennymi podwójnymi i pojedynczymi wiązaniami między atomami węgla tworzącymi pierścienie, a wiele z tych związków ma słodki zapach.
P: Jak nazywa się pierścień sześciu atomów węgla w związkach aromatycznych?
O: Nazwa pierścienia sześciu atomów węgla w związkach aromatycznych to pierścień benzenowy.
P: Jaka jest różnica między monocyklicznymi (MAH) i policyklicznymi (PAH) węglowodorami aromatycznymi?
O: Monocykliczne węglowodory aromatyczne (MAH) mają w swojej strukturze pojedynczy pierścień atomów węgla, podczas gdy policykliczne węglowodory aromatyczne (PAH) mają w swojej strukturze dwa lub więcej połączonych pierścieni atomów węgla.
P: Dlaczego węglowodory aromatyczne są nazywane "aromatycznymi"?
Węglowodory aromatyczne są nazywane "aromatycznymi", ponieważ wiele z nich ma słodki zapach.
P: Czym są heteroareny i czym różnią się od związków aromatycznych opartych na benzenie?
O: Heteroareny to związki nie oparte na benzenie, które są zgodne z regułą Hückla, które są również związkami aromatycznymi. W tych związkach co najmniej jeden atom węgla jest zastąpiony jednym z tlenu, azotu lub siarki.
P: Jaki jest najprostszy możliwy pierścień węglowodorowy?
O: Najprostszym możliwym pierścieniem węglowodorowym jest benzen.
P: Jakie są dwa rodzaje węglowodorów aromatycznych?
O: Dwa rodzaje węglowodorów aromatycznych to monocykliczne (MAH) i policykliczne (PAH) węglowodory aromatyczne.
Przeszukaj encyklopedię