Benzen (benzol, C6H6) — właściwości, zastosowania i zagrożenia
Benzen (C6H6) — właściwości, zastosowania i zagrożenia: bezbarwna, łatwopalna ciecz o słodkim zapachu; szerokie zastosowania przemysłowe i potwierdzone ryzyko rakotwórcze.
Benzen, znany również jako benzol, jest organicznym związkiem chemicznym o wzorze C6H6. Jest to bezbarwna i łatwopalna ciecz o słodkim zapachu. Cząsteczki benzenu tworzą pierścień składający się z sześciu atomów węgla, z których każdy jest połączony z jednym atomem wodoru. Jest to związek aromatyczny, co oznacza, że w pierścieniu występują naprzemiennie wiązania podwójne.
Benzen jest rakotwórczy, co oznacza, że może powodować raka. Ma wiele zastosowań w świecie rzeczywistym. Jest stosowany jako dodatek do benzyny, tworzyw sztucznych, kauczuku syntetycznego, barwników i jest rozpuszczalnikiem przemysłowym, co oznacza, że może rozpuszczać wiele innych cząsteczek chemicznych. Benzen jest również naturalnym składnikiem ropy naftowej i dlatego jest obecny w benzynie. Wiele leków zawiera składniki wykonane z benzenu.
Właściwości fizyczne i chemiczne
- Masa molowa: około 78,11 g·mol−1 (C6H6).
- Stan skupienia: bezbarwna ciecz o charakterystycznym, słodkawym zapachu; łatwopalna i lotna.
- Temperatura wrzenia: około 80,1 °C; temperatura topnienia: około 5,5 °C.
- Gęstość: około 0,88 g·cm−3 (w temperaturze pokojowej) — lżejszy od wody.
- Rozpuszczalność w wodzie: słaba (praktycznie niemieszalny w dużym stopniu), dobrze rozpuszcza się w wielu rozpuszczalnikach organicznych.
- Właściwości chemiczne: związek aromatyczny o delokalizowanym układzie elektronowym (rezonans), stabilny w stosunku do addycji typowych dla alkenów, reaguje głównie w reakcjach substytucji elektrofilowej (np. nitrowanie, sulfonowanie, halogenowanie, alkilowanie).
Budowa i mechanizm reakcji
Cząsteczka benzenu ma planarną strukturę pierścieniową z równomiernie rozłożonymi wiązaniami C–C o charakterze pośrednim między pojedynczym a podwójnym (opisane przez strukturę rezonansową). Ta delokalizacja elektronów nadaje benzenowi wyjątkową stabilność („energia aromatyczna”). W praktyce oznacza to, że zamiast typowych addycji wilkopodobnych do wiązań podwójnych, benzen podlega głównie podstawieniom, które zachowują aromatyczny układ pierścienia.
Zastosowania
- Surowiec chemiczny: surowiec do syntezy wielu związków aromatycznych — styrenu (do produkcji polistyrenu), fenolu, aniliny, cykloheksanu (prekursor nylonów) itp.
- Przemysł paliwowy: składnik ropy naftowej i benzyny; historycznie stosowany jako dodatek poprawiający liczbę oktanową (obecnie ograniczany ze względu na toksyczność).
- Rozpuszczalnik przemysłowy: używany w reakcjach chemicznych i w procesach oczyszczania, chociaż jego użycie maleje na rzecz mniej toksycznych zamienników.
- Produkcja barwników, tworzyw sztucznych, kauczuku syntetycznego, detergentów i niektórych leków (jako prekursor).
Zagrożenia dla zdrowia
Benzen jest substancją toksyczną i rakotwórczą. Organizacje zdrowotne, w tym Międzynarodowa Agencja Badań nad Rakiem (IARC), klasyfikują benzen jako czynnik rakotwórczy dla ludzi (grupa 1). Najważniejsze skutki zdrowotne obejmują:
- Chroniczne narażenie: uszkodzenie szpiku kostnego, prowadzące do zaburzeń krwiotwórczych — anemia aplastyczna, obniżenie liczby leukocytów i płytek krwi, zwiększone ryzyko białaczek (zwłaszcza ostrej białaczki szpikowej, AML).
- Ostre narażenie: działanie depresyjne na ośrodkowy układ nerwowy — zawroty głowy, bóle głowy, nudności, splątanie, utrata przytomności w przypadku wysokich stężeń.
- Inne: zmiany układu odpornościowego i rozrodczego przy długotrwałej ekspozycji; metabolity benzenu (np. benzenu tlenek) odpowiadają za dużą część jego toksyczności.
Narażenie, monitoring i normy
Główne drogi narażenia to drogi oddechowe (wdychanie oparów), wchłanianie przez skórę i, rzadziej, spożycie (np. poprzez skażoną wodę). W miejscach pracy narażenie występuje przy produkcji i przetwarzaniu benzenu, w rafineriach, zakładach chemicznych i przy obsłudze paliw.
W wielu krajach wprowadza się rygorystyczne limity ekspozycji w środowisku pracy oraz limity zawartości benzenu w paliwach i produktach konsumenckich. Typowe wartości dopuszczalne w miejscu pracy mieszczą się zwykle w niskich częściach ppm (rzędu 0,5–1 ppm jako wartość średnia), a dla krótkotrwałych ekspozycji stosuje się jeszcze niższe limity — jednak konkretne wartości i metody pomiaru zależą od lokalnych przepisów.
Postępowanie w razie ekspozycji i pierwsza pomoc
- Wdychanie: przenieść poszkodowanego na świeże powietrze, zapewnić spokój i ciepło; w razie utraty przytomności stosować resuscytację i natychmiast wezwać pomoc medyczną.
- Kontakt ze skórą: zdjąć skażone ubranie, opłukać dużą ilością wody z mydłem; w razie podrażnień zgłosić się do lekarza.
- Dostanie się do oczu: płukać czystą wodą przez co najmniej 15 minut i skonsultować się z okulistą.
- Połknięcie: nie wywoływać wymiotów; koniecznie zgłosić się do szpitala — ze względu na ryzyko aspiracji i uszkodzenia płuc.
Bezpieczeństwo pożarowe i magazynowanie
- Benzen jest wysoce łatwopalny — pary mogą tworzyć z powietrzem mieszaniny wybuchowe. Należy stosować odpowiednie zabezpieczenia przeciwwybuchowe, systemy wentylacji oraz aparaturę antystatyczną.
- Do gaszenia stosuje się pianę, proszek lub dwutlenek węgla; w przypadku większych pożarów używać mgły wodnej do chłodzenia zbiorników, pamiętając, że benzenu nie wolno bez kontroli zrzucać do kanalizacji i wód powierzchniowych.
- Przechowywać w szczelnych, dobrze oznakowanych pojemnikach, w chłodnym, dobrze wentylowanym miejscu z dala od źródeł zapłonu i utleniaczy.
Środowisko i utylizacja
Benzen jest lotny i łatwo paruje do atmosfery. W środowisku podlega fotoutlenianiu w atmosferze i biodegradacji w glebie/wodzie, ale wycieki mogą prowadzić do skażenia wód gruntowych oraz emisji lotnych związków do powietrza. W dużych stężeniach może być toksyczny dla organizmów wodnych. Utylizacja odpadów zawierających benzen powinna odbywać się zgodnie z przepisami — zwykle przez termiczne unieszkodliwianie w kontrolowanych warunkach lub przekazanie do wyspecjalizowanych zakładów przetwarzania odpadów niebezpiecznych.
Alternatywy i ograniczenia stosowania
Ze względu na toksyczność i właściwości rakotwórcze wiele zastosowań benzenu jest ograniczanych lub zastępowanych mniej szkodliwymi związkami (np. inne rozpuszczalniki, zmiany w recepturach przemysłowych). W przemyśle paliwowym wprowadzono limity zawartości benzenu w benzynie oraz technologie oczyszczania, które mają zmniejszyć emisję i narażenie ludności.
Podsumowanie
Benzen jest ważnym surowcem przemysłowym o unikalnej strukturze aromatycznej i szerokim spektrum zastosowań, ale jednocześnie substancją niebezpieczną — toksyczną i rakotwórczą. Z tego powodu jego stosowanie, magazynowanie i utylizacja podlegają ścisłym regulacjom, a w praktyce coraz częściej stosuje się zamienniki oraz technologie redukujące narażenie pracowników i środowiska.
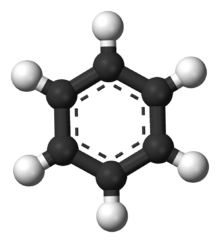
Model cząsteczki benzenu. Atomy węgla są pokazane jako czarne, a wodoru jako białe.
_1964,_MiNr_440.jpg)
W 1964 roku niemiecka poczta wydała znaczek upamiętniający 100-lecie odkrycia benzenu.
Struktura
Benzen posiada specjalne właściwości zwane aromatycznością. Wszystkie sześć atomów węgla w pierścieniu znajduje się w tej samej płaskiej płaszczyźnie. Aby uwzględnić wszystkie wiązania w pierścieniu sześciowęglowym, muszą występować naprzemiennie podwójne wiązania węglowe (układ sprzężony):
Gdyby benzen miał trzy wiązania podwójne, to trzy strony jego pierścienia byłyby krótsze niż pozostałe trzy strony. Dyfrakcja promieniowania rentgenowskiego pokazuje, że wszystkie sześć wiązań węgiel-węgiel w benzenie ma tę samą długość 140 pikometrów (pm). Długości wiązań C-C są większe niż wiązania podwójne (135 pm), ale krótsze niż wiązania pojedyncze (147 pm). Ta pośrednia odległość jest zgodna z delokalizacją elektronów: elektrony dla wiązania C-C są równo rozdzielone pomiędzy każde z sześciu atomów węgla. Cząsteczka jest planarna. Jedną z reprezentacji jest to, że struktura istnieje jako superpozycja tak zwanych struktur rezonansowych, a nie każda z nich osobno. (Innymi słowy, wiązania podwójne w cząsteczce szybko przełączają się pomiędzy parami atomów węgla). Delokalizowanie elektronów jest jednym z wyjaśnień stabilności termodynamicznej benzenu i pokrewnych związków aromatycznych. Jest prawdopodobne, że stabilność ta przyczynia się do szczególnych właściwości molekularnych i chemicznych znanych jako aromatyczność. Aby wskazać na zdelokalizowaną naturę wiązania, benzen jest często przedstawiany z okręgiem wewnątrz heksagonalnego układu atomów węgla.
Jak to często bywa w chemii organicznej, atomy węgla na powyższym schemacie nie zostały oznaczone. Zdając sobie sprawę, że każdy węgiel ma 2p elektrony, każdy węgiel oddaje elektron do zdelokalizowanego pierścienia powyżej i poniżej pierścienia benzenu. To jest nakładanie się p-orbitali zarówno powyżej jak i poniżej pierścienia, które tworzy chmury pi.
W 1986 r. niektórzy chemicy zakwestionowali pogląd o delokalizacji benzenu w artykule opublikowanym w czasopiśmie Nature. Wykazali oni, że elektrony w benzenie są prawie na pewno zlokalizowane do poszczególnych atomów węgla. Wykazali, że właściwości aromatyczne benzenu pochodzą raczej ze sprzężenia spinowego niż z delokalizacji elektronów. Inni naukowcy napisali artykuły popierające ten pogląd w Nature w 1987 roku. Ale, chemicy są powolne, aby przełączyć się z delokalizacji elektronów widok.
Pochodne benzenu występują na tyle często jako składnik cząsteczek organicznych, że istnieje symbol Unicode w bloku technicznym Miscellaneous z kodem U+232C (⌬) do reprezentowania go z trzema podwójnymi wiązaniami, oraz U+23E3 (⏣) dla wersji zdelokalizowanej.
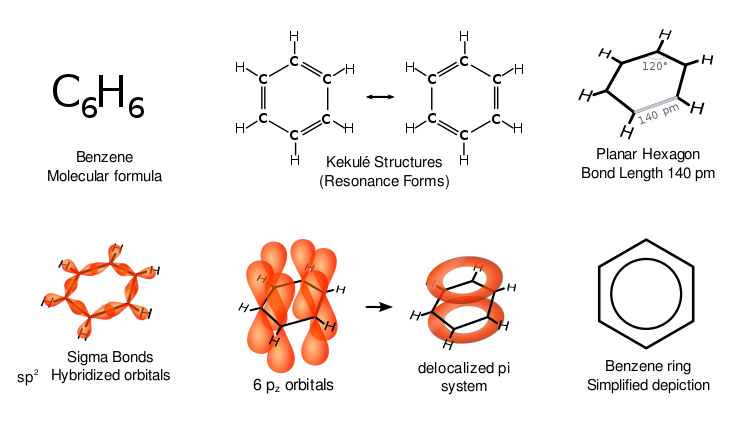
Różne reprezentacje benzenu
Pytania i odpowiedzi
P: Co to jest benzen?
A: Benzen jest organicznym związkiem chemicznym.
P: Jaki jest wzór chemiczny benzenu?
A: Wzór chemiczny benzenu to C6H6.
Q: Jaki jest wygląd i zapach benzenu?
O: Benzen jest bezbarwną i łatwopalną cieczą o słodkim zapachu.
P: Jaka jest budowa cząsteczki benzenu?
O: Cząsteczka benzenu to pierścień złożony z sześciu atomów węgla, z których każdy jest połączony z jednym atomem wodoru. Jest to związek aromatyczny, co oznacza, że pierścień posiada naprzemienne wiązania podwójne.
P: Czy benzen jest rakotwórczy?
O: Tak, benzen jest rakotwórczy, co oznacza, że może powodować raka.
P: Jakie są niektóre rzeczywiste zastosowania benzenu?
O: Benzen jest stosowany jako dodatek do benzyny, tworzyw sztucznych, kauczuku syntetycznego, barwników i jest rozpuszczalnikiem przemysłowym, co oznacza, że może rozpuszczać wiele innych cząsteczek chemicznych. Wiele leków również zawiera części wykonane z benzenu.
P: Gdzie występuje benzen?
O: Benzen jest naturalnym składnikiem ropy naftowej i dlatego jest obecny w benzynie.
Przeszukaj encyklopedię