Fenol — wzór, właściwości i zastosowania związku C6H5OH
Fenol (C6H5OH) — wzór, właściwości i zastosowania: produkcja chemiczna, detergenty, herbicydy i przemysł. Poznaj cechy, reakcje i praktyczne użycia tego ważnego związku.
Fenol jest związkiem organicznym o wzorze C6H5OH. Jest to zwykle białe, krystaliczne ciało stałe, które pod wpływem powietrza może zmieniać barwę na różową lub brązową wskutek utleniania. Posiada grupę OH (grupę hydroksylową) związaną z pierścieniem benzenowym. Fenol bywa klasyfikowany jako alkohol, jednak jego właściwości chemiczne różnią się od typowych alkoholi alifatycznych ze względu na sprzężenie z pierścieniem aromatycznym. Ponieważ grupa aromatyczna przyciąga elektrony i jednocześnie układ aromatyczny stabilizuje jon fenolanowy, związek ten jest stosunkowo kwaśny w porównaniu z alifatycznymi alkoholami. Fenol przemysłowo otrzymuje się głównie metodą kumenową z surowców naftowych, choć historycznie i nadal częściowo pozyskiwany jest z smoły węglowej; w produkcji wykorzystuje się surowce pochodzące z ropy naftowej. Jest to ważna cząsteczka, ponieważ stanowi surowiec do syntez wielu innych związków i materiałów. Stosowana jest również w detergentach i herbicydach, a także w produkcji tworzyw i produktów farmaceutycznych.
Wzór i budowa
Fenol ma wzór sumaryczny C6H5OH. Składa się z pierścienia benzenowego, do którego przyłączona jest grupa hydroksylowa. Elektrony układu aromatycznego współoddziałują z grupą –OH, co wpływa na właściwości kwasowo‑zasadowe i reaktywność pierścienia (np. ułatwiają podstawianie elektrofilowe w pozycjach orto i para).
Właściwości fizyczne
- Stan skupienia: białe, krystaliczne ciało stałe w temperaturze pokojowej (może przebarwiać się pod wpływem światła i powietrza).
- Temperatura topnienia: ~40,5 °C (stąd może być cieczą lekko powyżej tej temperatury).
- Temperatura wrzenia: ~181,7 °C.
- Gęstość: około 1,07 g/cm3 (w 20 °C).
- Rozpuszczalność: miesza się z wodą w ograniczonym stopniu; lepiej rozpuszcza się w rozpuszczalnikach organicznych. Tworzy stężone roztwory alkaliczne przy tworzeniu soli fenolanowych.
Właściwości chemiczne
- Kwasowość: fenol jest znacznie kwaśniejszy niż zwykłe alkohole; pKa ≈ 10 (w wodzie). Wynika to ze stabilizacji jonu fenolanowego przez rezonans.
- Reakcje podstawienia elektrofilowego: grupa –OH aktywuje pierścień i kieruje podstawianie głównie w pozycje orto i para (np. nitracja, bromowanie, sulfonowanie).
- Tworzenie soli i estrów: fenol reaguje z zasadami, tworząc fenolany (soli), oraz z kwasami (i ich pochodnymi) tworząc estry; z halogenkami alkilowymi powstają etery (alkilofenole).
- Utlenianie: fenole mogą być utleniane do chinonów lub innych produktów zależnie od warunków utleniania.
- Reakcje specyficzne: Kolbe‑Schmitt (karboksylacja fenolanów do kwasu salicylowego) jest ważną reakcją w syntezie związków farmaceutycznych (np. kwasu salicylowego).
Otrzymywanie
Główna metoda przemysłowa to proces kumenowy (Hocka): alkilacja benzenu propylem (powstaje kumen), który jest następnie utleniany do kumenowego nadtlenku i rozkładany do fenolu i acetonowego produktu ubocznego (aceton). W przeszłości fenol otrzymywano z smoły węglowej (produkt uboczny koksowania węgla). W warunkach laboratoryjnych można go otrzymać m.in. przez hydrolizę chlorku arylowego, oksydację cykloheksanolu/aminowania ze związków pochodnych czy przez wspomnianą reakcję Kolbe‑Schmitta z fenolanów.
Zastosowania
Fenol ma szeroki zakres zastosowań przemysłowych i laboratoryjnych. Najważniejsze z nich to:
- Produkcja żywic fenolowo‑formalnych (np. żywice fenolowe, znane jako bakelit) — stosowane do wyrobów izolacyjnych, elementów konstrukcyjnych i klejów.
- Synteza bisfenolu A (BPA) — surowiec do produkcji poliwęglanów i niektórych żywic epoksydowych.
- Produkcja prekursorów do tworzyw, barwników, dodatków do paliw, leków i pestycydów (m.in. niektóre herbicydy i intermedianty).
- Składnik niektórych detergentów (historycznie nonylofenole i pochodne), chociaż niektóre z nich są dziś ograniczane ze względu na toksyczność i działanie hormonalne.
- Użycie jako środek dezynfekujący i konserwujący w przeszłości (np. fenol był jednym z pierwszych środków antyseptycznych w chirurgii), choć ze względu na toksyczność stosowanie takie jest obecnie ograniczone.
Toksyczność i bezpieczeństwo
Fenol jest substancją toksyczną i żrącą. Może powodować oparzenia skóry i błon śluzowych, a wchłonięty przez skórę lub drogą pokarmową i oddechową wywoływać objawy ogólne (bóle głowy, zawroty, nudności, uszkodzenia wątroby i nerek, zaburzenia świadomości). Długotrwała ekspozycja oraz wdychanie oparów są niebezpieczne. Przy pracy z fenolem należy stosować odpowiednie środki ochrony osobistej: rękawice odporne na chemikalia, okulary ochronne, wentylację i odzież ochronną. W razie rozlania i kontaktu ze skórą zaleca się natychmiastowe spłukanie dużą ilością wody i usunięcie skażonej odzieży; w poważniejszych przypadkach konieczna jest pomoc medyczna.
Fenol jest również toksyczny dla organizmów wodnych — przed wprowadzeniem do środowiska przemysłowe odpady wymagają właściwej neutralizacji i oczyszczania.
Podsumowanie
Fenol (C6H5OH) to podstawowy surowiec chemiczny o licznych zastosowaniach przemysłowych, zwłaszcza w produkcji żywic, tworzyw i substancji pośrednich. Jego specyficzne właściwości wynikające z obecności grupy hydroksylowej sprzężonej z pierścieniem aromatycznym determinują zarówno przydatność w syntezach, jak i konieczność zachowania szczególnych środków ostrożności przy jego stosowaniu.
Struktura fenolu
Właściwości
Kwasowość
Fenol ma pKa równe około 10. Dla normalnych alkoholi liczba ta wynosi zazwyczaj około 15. Jednak fenol jest mniej kwaśny niż związki takie jak kwasy karboksylowe. Powodem tej wysokiej kwasowości jest rezonansowa stabilizacja cząsteczki, gdy staje się ona anionem.
Reakcje
Fenol może bardzo dobrze przeprowadzać reakcje elektrofilowej substytucji aromatycznej. Dzieje się tak dlatego, że samotna para na atomie tlenu może oddawać elektrony przez pierścień benzenowy do elektrofilu. Ponieważ jednak samotna para ma tak wysoką energię, czasami fenol reaguje zbyt wiele razy.
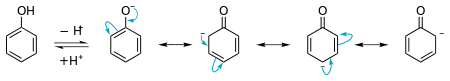
Schemat przedstawiający stabilizację pary samotnej na tlenie w fenolu. Wyjaśnia to kwasowość.
Historia
Fenol został po raz pierwszy odkryty w 1834 roku. Został znaleziony jako produkt spalania węgla. Jednym z jego pierwszych zastosowań było zabijanie zarazków w chirurgii. Do dziś jest on stosowany w niektórych środkach przeciwbólowych. Podczas II wojny światowej fenol był również wykorzystywany przez nazistów. Używali go w obozach koncentracyjnych do szybkiego zabijania małych grup ludzi.
Przeszukaj encyklopedię