Mechanizmy reakcji chemicznych: definicja, stany pośrednie i typy
Poznaj mechanizmy reakcji chemicznych: definicje, stany pośrednie i przejściowe oraz główne typy (substytucja, eliminacja, addycja) z praktycznymi przykładami.
Mechanizm reakcji to opisanie krok po kroku, jak przebiega reakcja chemiczna. Zazwyczaj w obserwacji eksperymentalnej widać jedynie przemiany substrat → produkt; to, co powstaje "pomiędzy", często reaguje zbyt szybko, aby zaobserwować to bezpośrednio. Takie krótkotrwałe cząstki nazywamy stanami pośrednimi. Podczas przechodzenia z jednego stanu pośredniego do drugiego występuje natomiast stan przejściowy — konfiguracja molekularna odpowiadająca maksimum energii pośredniej bariery reakcyjnej. Zrozumienie poszczególnych etapów mechanizmu pozwala nie tylko wyjaśnić przebieg reakcji, lecz także projektować warunki, które zwiększą wydajność, selektywność lub szybkość przemiany.
Stany pośrednie i stany przejściowe
Stany pośrednie to rzeczywiste, względnie dłużej trwające cząstki (np. karbokationy, rodniki, związki kompleksowe), które można czasem wykryć lub wyizolować. Stany przejściowe to krótkotrwałe układy odpowiadające szczytom energii w profilu energetycznym reakcji — nie są izolowalne i opisuje się je raczej przez obliczenia kwantowo-chemiczne i dane kinetyczne. Przydatne pojęcia:
- Profil energetyczny — wykres energii w funkcji reakcji ilustruje energię aktywacji i względne energie substratów, produktów i pośrednich.
- Hammond — zasada Hammonda pomaga przewidzieć wygląd stanu przejściowego (bardziej przypominający substraty lub produkty) w zależności od egzotermiczności/ endotermiczności kroku.
- Równowaga między szybkością tworzenia i rozpadu stanów pośrednich decyduje o ich wykrywalności.
Typy mechanizmów (najważniejsze przykłady)
Istnieje wiele typów mechanizmów reakcji. W chemii organicznej najczęściej spotykane są: substytucja nukleofilowa, eliminacja i addycja. Poniżej omówiono najistotniejsze warianty oraz inne klasy mechanizmów:
- Substytucja nukleofilowa (SN)
- SN1 — dwukrokowy mechanizm z tworzeniem karbokationu jako stanu pośredniego; szybkość zależy od koncentracji substratu (pierwszy rząd kinetyczny).
- SN2 — mechanizm jednocząstkowy (concerted): nukleofil atakuje od tyłu, jednocześnie odchodzi grupa opuszczająca; wpływ stereochemii (inwersja konfiguracji).
- Eliminacja
- E1 — eliminacja przez najpierw tworzenie karbokationu (analogicznie do SN1), potem odłączenie protonu.
- E2 — jednoetapowa eliminacja, sprzężona z odrywaniem protonu i odchodzeniem grupy; zależy od orientacji (anti-coplanar) przy eliminacji w związkach cyklicznych.
- Addycja
- Addycja elektrofilowa do wiązań wielokrotnych (np. alkenów): powstają karbokationy lub kompleksy bromoniowe pośrednio.
- Addycja rodnikowa i addycje katalizowane przez metale przejściowe (np. hydroborowanie, hydrogenacja heterogenna).
- Mechanizmy rodnikowe — inicjacja, propagacja i terminacja; istotne w halogenowaniu alkanów lub polimeryzacji.
- Mechanizmy pericykliczne — reakcji zachodzące w sposób skoordynowany bez tworzenia oddzielnych stanów pośrednich (np. reakcje Dielsa–Aldera, elektrocykliczne).
- Reakcje redoks i mechanizmy elektrochemiczne — przeniesienie elektronów między reagentami, często przez pośrednie kompleksy lub stany o zmienionej liczbie utlenienia.
- Mechanizmy kwas‑zasada — protonowanie/deprotonowanie może być krokiem szybkościotwórczym lub pomocniczym wpływającym na dalsze etapy.
- Mechanizmy katalityczne (homogeniczne i heterogeniczne) — katalizatory zmieniają ścieżkę reakcji, obniżając energię aktywacji i często tworząc nowe, wykrywalne stany pośrednie (np. kompleksy metaliczne).
Rysowanie mechanizmów: przesuwanie strzałek
Czasami używa się przesuwania strzałek, aby narysować jak elektrony przemieszczają się podczas reakcji. Zasady konwencji:
- Pełne strzałki elektronowe (z ogona od pary elektronowej lub wiązania do atomu/związku) pokazują ruch par elektronów.
- Strzałki półpełne używane są dla pojedynczych elektronów w mechanizmach rodnikowych.
- Przesuwanie strzałek pomaga zrozumieć, które wiązania są tworzone, a które zrywane, oraz przewidzieć ładunki i rozmieszczenie elektronów w stanach pośrednich.
Czynniki wpływające na mechanizm
- Siła nukleofila/elektrofila — decyduje o tym, czy przebiegnie SN1 czy SN2, czy inny wariant reakcji.
- Grupa opuszczająca — dobra grupa opuszczająca (np. halogen zdelokalizowany) sprzyja substytucjom.
- Rozpuszczalnik — polarny protogeniczny (np. alkohole) stabilizuje karbokationy; aprotyczny sprzyja SN2; rozpuszczalnik może też stabilizować lub destabilizować przejściowe jony.
- Temperatura — wpływa na kinetykę i równowagę; wysokie temperatury często sprzyjają eliminacji nad substytucją.
- Stereoelektroniczne wymagania — orientacja atomów i orbitali (np. anti-periplanar dla E2) może warunkować możliwość zajścia danego kroku.
- Katalizatory i enzymy — przyspieszają reakcje, często oferując alternatywną ścieżkę o niższej energii aktywacji i specyficznej stereoselektywności.
Kinetyka, krok decydujący i kontrola produktu
Mechanizm określa, który etap jest krokiem ograniczającym szybkość i jak reagują szybkości poszczególnych etapów. Ważne rozróżnienia:
- Kontrola kinetyczna — produkt powstający szybciej, nawet jeśli jest mniej stabilny.
- Kontrola termodynamiczna — produkt bardziej stabilny energetycznie, może dominować przy długim czasie reakcji lub wyższej temperaturze.
Jak poznajemy mechanizmy — metody eksperymentalne i obliczeniowe
- Badania kinetyczne (porządkowanie rzędów reakcji, wpływ stężeń) — pozwalają identyfikować krok szybkościotwórczy.
- Spektroskopia (UV‑Vis, IR, NMR, ESR) — wykrywanie stanów pośrednich lub zmian strukturalnych.
- Izotopowe eksperymenty śledzące (np. efekt izotopowy KIE) — ujawniające przenoszenie protonów lub udział wiązań C–H w kroku decydującym.
- Metody komputerowe (obliczenia DFT, modelowanie przejściowych struktur) — pozwalają na analizę geometrii i energii stanów przejściowych i pośrednich.
Znaczenie praktyczne
Zrozumienie mechanizmu jest kluczowe w syntezie organicznej, chemii leków, katalizie przemysłowej i biochemii. Pozwala na:
- projektowanie selektywnych syntez i uniknięcie produktów ubocznych,
- optymalizację warunków reakcji (rozpuszczalnik, temperatura, katalizator),
- rozwiązywanie problemów takich jak inwersja konfiguracji czy utrata aktywności katalizatora,
- wyjaśnianie działania enzymów przez porównanie ich mechanizmów z mechanizmami chemicznymi.
Podsumowując, mechanizm reakcji to szczegółowy plan przebiegu przemiany chemicznej: od pierwszego zetknięcia reagentów, przez powstawanie i rozpady stanów pośrednich i przejściowych, aż do ostatecznych produktów. Zastosowanie narzędzi teoretycznych i eksperymentalnych pozwala nie tylko opisać ten przebieg, ale też celowo go modyfikować — co jest fundamentem współczesnej chemii syntetycznej i katalizy.
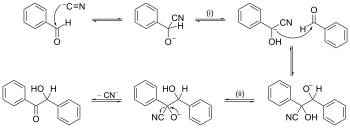
Przykład mechanizmu reakcji z przesuwaniem strzałki
Pytania i odpowiedzi
P: Co to jest mechanizm reakcji?
O: Mechanizm reakcji to wyjaśnienie krok po kroku, jak przebiega reakcja chemiczna.
P: Dlaczego ważne jest zrozumienie wszystkich etapów mechanizmu reakcji?
O: Zrozumienie wszystkich etapów mechanizmu reakcji jest ważne, aby zrozumieć trudne reakcje lub spróbować sprawić, by reakcja przebiegała w określony sposób.
P: Czym są produkty pośrednie w reakcji chemicznej?
O: Związki pośrednie to substancje, które powstają pomiędzy reakcjami zbyt szybko, aby były widoczne w reakcji chemicznej.
P: Czym jest stan przejściowy w reakcji chemicznej?
Stan przejściowy to przejście z jednego związku pośredniego do drugiego podczas reakcji chemicznej.
P: Jakie są najpopularniejsze typy mechanizmów reakcji w chemii organicznej?
O: Najpopularniejsze typy mechanizmów reakcji w chemii organicznej to substytucja nukleofilowa, eliminacja i addycja.
P: Czym jest pchanie strzałki w mechanizmie reakcji chemicznej?
O: Pchanie strzałki jest czasami używane do narysowania, w jaki sposób elektrony poruszają się podczas reakcji. Ułatwia to sprawdzenie, które wiązania są tworzone, a które zrywane podczas procesu.
P: Jakie informacje można uzyskać dzięki zrozumieniu mechanizmu reakcji?
O: Zrozumienie mechanizmu reakcji może dostarczyć informacji o tym, jak sprawić, by reakcja przebiegała w pożądany sposób lub jak zrozumieć trudniejsze reakcje.
Przeszukaj encyklopedię