Addycja (reakcja addycji) w chemii organicznej — definicja i przykłady
Poznaj addycję w chemii organicznej: definicja, mechanizmy i przykłady reakcji (woda, atak nukleofilowy). Jasne wyjaśnienia i ilustracje.
W chemii organicznej reakcja addycji zachodzi wtedy, gdy dwie cząsteczki łączą się, aby utworzyć jedną większą cząsteczkę. Do addycji dochodzi zwykle wtedy, gdy jedna z reagentów posiada wiązanie podwójne lub potrójne (np. C=C, C≡C), chociaż możliwe są też addycje do innych rodzajów wielokrotnych wiązań, takich jak C=O, C=N itp. Mogą to być więc wiązania węgiel–węgiel, jak i węgiel–tlen, węgiel–azot i inne. W typowych mechanizmach jedna z dwóch cząsteczek działa jako nukleofil — nukleofilem i to właśnie ona przekazuje elektrony drugiej cząsteczce — natomiast druga cząsteczka pełni rolę elektrofila — elektropolem i to właśnie ona otrzymuje elektrony.
Mechanizm i klasyfikacja reakcji addycji
Reakcje addycji można podzielić według mechanizmu i rodzajów uczestniczących reagentów:
- Addycja elektrofilowa – charakterystyczna dla alkenów i alkinów. Pi-orbita wiązania wielokrotnego atakuje elektrofila, powstaje karbokation lub kompleks pośredni, a następnie nukleofil dołącza do centrum karbokationowego.
- Addycja nukleofilowa – typowa dla związków karbonylowych (C=O). Nukleofil atakuje atom węgla karbonylowego, tworząc tetraedryczny stan pośredni (np. hemiketal, alkohol po redukcji).
- Addycja rodnikowa – zachodzi przez mechanizm jednorodnikowy (np. inicjowana przez nadtlenki); istotna w niektórych addycjach H–X prowadzących do odwrócenia reguły Markownikowa przy udziale rodników.
- Cycloaddycje (addycje pericykliczne) – reakcje przebiegające w sposób skoordynowany (concerted), np. reakcja Dielsa–Aldera (4+2), w których następuje jednoczesne tworzenie kilku wiązań.
Zasady regio- i stereochemii
- Regioselektywność (np. reguła Markownikowa) – przy addycji H–X do niesymetrycznego alkenu atak protona zwykle prowadzi do najbardziej stabilnego karbokationu, co skutkuje przyłączeniem grupy X do bardziej podstawionego atomu węgla (Markownikow). Istnieją metody (np. hydroboracja-oksydacja, addycja rodnikowa), które dają produkt anti‑Markownikow.
- Stereoselektywność – addycje mogą przebiegać z przyłączeniem atomów po tej samej stronie płaszczyzny (syn) lub po przeciwnych stronach (anti). Przykładowo, katalityczna hydrogenacja daje addycję syn, natomiast addycja Br2 do alkenu zachodzi przez międzykompleks (bromonium ion) i prowadzi do produktu o konfiguracji anti.
- Przestawienia – w mechanizmach z karbokationami możliwe są przestawienia (hydrydowe lub alkilowe), które wpływają na ostateczny produkt addycji.
Przykłady typowych reakcji addycji
- Hydratacja alkenów (dodanie wody do wiązania podwójnego) — zwykle katalizowana kwasem, prowadzi do alkoholi (z regułą Markownikowa, chyba że zastosujemy inne warunki jak hydroboracja-oksydacja).
- Hydrogenacja (H2, katalizatory metaliczne, np. Pd/C) — addycja wodoru do wiązania C=C lub C≡C, prowadząca do nasycenia związku.
- Addycja halogenów (np. Br2) — daje diwodorozwiązki w położeniach sąsiednich (vicinal dihalogeny) z mechanizmem przez bromonium ion.
- Hydrohalogenacja (HBr, HCl) — addycja kwasu halogenowodorowego; przebieg regioselektywny (Markownikow), z możliwymi przestawieniami karbokationowymi.
- Hydroboracja-oksydacja — addycja B–H w sposób syn i anti‑Markownikow, po utlenieniu daje alkohole w położeniu mniej podstawionym.
- Addycja nukleofilowa do karbonylu — np. atak alkoholu na aldehyd/keton tworzy hemiacetal/hemiketal, redukcja (NaBH4, LiAlH4) daje alkohole.
- Cycloaddycje, np. reakcja Dielsa–Aldera — łączenie dienu i dienofilu w pierścień sześcioczłonowy przy zachowaniu stereochemii reagentów.
- Addycje prowadzące do polimeryzacji (addycja łańcuchowa) — np. polimeryzacja etylenu (radikalna, anionowa lub kationowa) tworzy polietylen.
Kataliza, warunki i odwracalność
- Katalizatory — reakcje addycji często wymagają katalizatorów: kwasów protolitycznych (H+), kwasów Lewisa, metali przejściowych (np. katalizatory hydrogenacji), inicjatorów rodnikowych (nadtlenki).
- Warunki reakcji — temperatura, rozpuszczalnik i obecność inhibitorów wpływają na przebieg i selektywność addycji. Niektóre addycje przebiegają łagodnie w temperaturze pokojowej, inne wymagają podwyższonej temperatury lub ciśnienia (np. hydrogenacja pod ciśnieniem H2).
- Odwracalność — addycja jest często odwracalna: reakcją przeciwną jest eliminacja (dehydratacja, dehydrohalogenacja itp.). W układach równowagowych pozycja równowagi zależy od warunków termodynamicznych i kinetycznych.
Zastosowania praktyczne
Reakcje addycji są fundamentem syntezy organicznej i przemysłowej produkcji związków: tworzenie alkoholi, halogenoalkanów, polimerów (plastików), chemii leków i materiałów. Dzięki różnym mechanizmom i katalizatorom można uzyskać wysoką selektywność regio‑ i stereochemiczną, co jest kluczowe w syntezach związków biologicznie aktywnych.
Podsumowanie
Reakcja addycji polega na przyłączeniu jednego reagentu do drugiego przez rozerwanie wiązania wielokrotnego i utworzenie nowych wiązań pojedynczych. W zależności od rodzaju reagentów i mechanizmu wyróżniamy addycje elektrofilowe, nukleofilowe, rodnikowe i cykliczne. Kluczowymi aspektami są mechanizm, zasady regio‑ i stereochemii oraz warunki reakcji — a znajomość tych zagadnień pozwala projektować selektywne i efektywne syntezy organiczne. Typowymi przykładami są dodanie wody do wiązania podwójnego i atak nukleofilowy na karbonyl.
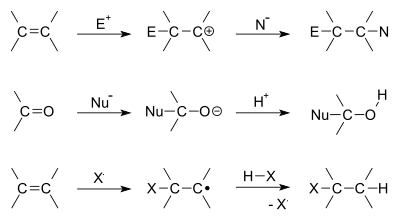
Niektóre przykłady reakcji addycji
Pytania i odpowiedzi
P: Co to jest reakcja addycji w chemii organicznej?
O: Reakcja addycji polega na połączeniu dwóch cząsteczek w celu utworzenia większej cząsteczki i może zachodzić tylko wtedy, gdy jedna z cząsteczek ma wiązanie podwójne lub potrójne.
P: Jakie rodzaje wiązań mogą wchodzić w reakcje addycji?
O: Wiązania węgiel-węgiel, węgiel-tlen, węgiel-azot i inne mogą wchodzić w reakcje addycji.
P: Co to jest nukleofil w reakcji addycji?
O: Nukleofil to cząsteczka, która oddaje elektrony innej cząsteczce, aby utworzyć nowe wiązanie.
P: Co to jest elektrofil w reakcji addycji?
A: Elektrofil to cząsteczka, która przyjmuje elektrony, aby utworzyć nowe wiązanie.
P: Czym różni się reakcja addycji od reakcji eliminacji?
O: W reakcji addycji dwie cząsteczki łączą się, tworząc większą cząsteczkę, podczas gdy reakcja eliminacji polega na rozłożeniu większej cząsteczki na dwie mniejsze.
P: Jaki jest przykład reakcji addycji?
O: Dodanie wody do wiązania podwójnego i atak nukleofilowy na karbonyl są typowymi przykładami reakcji addycji.
P: Czy reakcje addycji mogą zachodzić bez wiązań podwójnych lub potrójnych?
O: Nie, reakcje addycji wymagają wiązania podwójnego lub potrójnego w co najmniej jednej z cząsteczek biorących udział w reakcji.
Przeszukaj encyklopedię