Stan przejściowy
W reakcji chemicznej, stan przejściowy jest punktem, w którym występuje maksymalna wartość energii. Energia ta nazywana jest energią aktywacji. Kiedy dwie lub więcej cząsteczek zostanie zmieszanych, uderzą o siebie. Jeśli uderzą z wystarczającą energią, aby przejść przez stan przejściowy, zareagują i utworzą nowe cząsteczki. W stanie przejściowym tworzą się nowe wiązania, a stare są zrywane. Na wykresie lub rysunku stan przejściowy jest często oznaczany symbolem podwójnego sztyletu ‡.
Bardzo trudno jest badać stan przejściowy. Dzieje się tak dlatego, że ma on tak wysoką energię, że cząsteczki pozostają w tej formie przez bardzo krótki czas, zazwyczaj femtosekundy. Ważne jest, aby nie mylić stanów przejściowych z intermediatami. Stany pośrednie występują w minimalnych punktach energetycznych i mogą żyć przez bardzo długi czas. Jednak podobnie jak stan przejściowy, stan pośredni znajduje się pomiędzy reagentami i produktami reakcji.
Studiowanie stanów przejściowych jest bardzo ważne dla zrozumienia mechanizmów reakcji. Istnieją teorie i programy komputerowe, które mogą być użyte do obliczenia jak wygląda stan przejściowy. Jest to część kinetyki chemicznej.
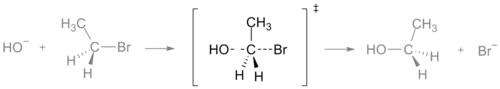
Stan przejściowy w reakcji SN2
Pytania i odpowiedzi
P: Czym jest stan przejściowy w reakcji chemicznej?
Stan przejściowy to punkt, w którym występuje maksymalna wartość energii w reakcji chemicznej.
P: Czym jest energia aktywacji w reakcji chemicznej?
O: Energia wymagana do zajścia reakcji nazywana jest energią aktywacji.
P: Co się dzieje, gdy dwie lub więcej cząsteczek miesza się w reakcji chemicznej?
O: Gdy dwie lub więcej cząsteczek zostanie zmieszanych, uderzą o siebie. Jeśli uderzą z wystarczającą energią, aby przejść przez stan przejściowy, zareagują i utworzą nowe cząsteczki.
P: Do czego służy symbol podwójnego sztyletu (‡) na wykresie lub rysunku reakcji chemicznej?
O: Symbol podwójnego sztyletu (‡) służy do oznaczania stanu przejściowego na wykresie lub rysunku reakcji chemicznej.
P: Dlaczego trudno jest zbadać stan przejściowy w reakcji chemicznej?
O: Bardzo trudno jest badać stan przejściowy w reakcji chemicznej, ponieważ ma on tak wysoką energię, że cząsteczki pozostają w tej formie przez bardzo krótki czas, zwykle femtosekundy.
P: Czym jest stan pośredni w reakcji chemicznej?
O: Stan pośredni to cząsteczka, która znajduje się w minimalnych punktach energii w reakcji chemicznej i może żyć przez bardzo długi czas.
P: Dlaczego badanie stanów przejściowych jest ważne dla zrozumienia mechanizmów reakcji?
O: Badanie stanów przejściowych jest ważne w zrozumieniu mechanizmów reakcji, ponieważ pomaga określić, w jaki sposób zachodzi reakcja i jak ją kontrolować lub nią manipulować.
Przeszukaj encyklopedię