Orbital molekularny
W chemii, orbital molekularny (lub MO) wyjaśnia, co dzieje się z elektronami, gdy atomy łączą się w cząsteczce. MO jest matematyczną funkcją, która opisuje falowe zachowanie elektronu w cząsteczce. Chemicy używają takich funkcji do przewidywania lub wyjaśniania właściwości chemicznych i fizycznych. Na przykład, funkcje te mogą określić prawdopodobieństwo znalezienia elektronu w dowolnym określonym obszarze.
Chemicy zazwyczaj budują modele matematyczne orbit molekularnych poprzez łączenie orbit atomowych. Można również wykorzystać orbitały hybrydowe z każdego atomu cząsteczki, lub inne orbitały molekularne z grup atomów. Na tych funkcjach mogą pracować komputery. Orbitale molekularne pozwalają chemikom na zastosowanie mechaniki kwantowej do badania cząsteczek. MOs odpowiadają na pytania o to, jak atomy w cząsteczkach łączą się ze sobą. Różne zaokrąglone kształty na schemacie orbitalnym wskazują, gdzie najprawdopodobniej znajdowałyby się elektrony w atomie.
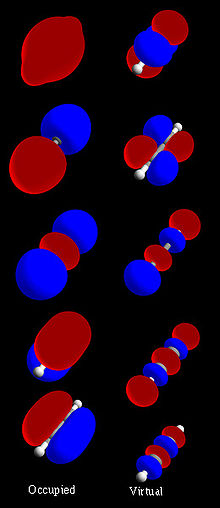
Rysunek 1: Kompletny zestaw molekularny orbitalny acetylenu (H-C≡C-H)
Historia
Słowo "orbital" zostało po raz pierwszy użyte w języku angielskim przez Roberta S. Mullikena. O MO pisał wcześniej niemiecki fizyk Erwin Schrödinger. Schrödinger nazwał je Eigenfunktion.
Fizyk Max Born opisał teorię stojącą za orbitami molekularnymi w 1926 roku. Dziś jest ona znana jako reguła Borna i stanowi część kopenhaskiej interpretacji mechaniki kwantowej. Początkowo zaproponowana teoria ta nie zgadzała się z modelem atomu Nielsa Bohra. Model Bohra opisywał elektrony jako "orbitujące" wokół jądra, ponieważ poruszały się one w kółko. Jednakże, model Borna w końcu zyskał popularne poparcie, ponieważ był w stanie opisać położenie elektronów w cząsteczkach i wyjaśnić szereg wcześniej niewytłumaczalnych reakcji chemicznych.
Przegląd
Orbity atomowe przewidują położenie elektronu w atomie. Orbity molekularne powstają, gdy orbity atomowe są skupione razem. Orbita molekularna może dać informację o konfiguracji elektronu w cząsteczce. Konfiguracja elektronów jest najbardziej prawdopodobnym położeniem, a energia jednego (lub jednej) pary elektronów. Najczęściej MO jest reprezentowany jako liniowa kombinacja orbit atomowych (metoda LCAO-MO), szczególnie w przybliżeniu. Oznacza to, że chemicy zakładaj±, że prawdopodobieństwo istnienia elektronu w dowolnym punkcie cz±steczki jest sum± prawdopodobieństw istnienia tam elektronu w oparciu o poszczególne orbity atomowe. LCAO-MO jest prostym modelem wiązania w molekułach i jest ważny dla badania orbitalnej teorii molekularnej.
Chemicy teoretyczni używają komputerów do obliczania MO różnych molekuł (zarówno rzeczywistych, jak i wyimaginowanych). Komputer może narysować wykresy "chmury", aby pokazać jak prawdopodobny będzie elektron w dowolnym regionie. Komputer może również podać informacje o fizycznych właściwościach cząsteczki. Mogą również powiedzieć, ile energii potrzeba do utworzenia cząsteczki. To pomaga chemikom powiedzieć, czy niektóre małe molekuły mogą być połączone w większe molekuły.
Większość współczesnych sposobów wykonywania chemii obliczeniowej zaczyna się od obliczania MO systemu. Pole elektryczne każdego MO jest generowane przez jądra wszystkich atomów i jakiś średni rozkład pozostałych elektronów.
Analogia
Zrozumienie MOs jest jak zadanie poznania, gdzie każdy pracownik znajduje się w dużym sklepie z artykułami wyposażenia wnętrz (bez zaglądania do środka sklepu). Analityk zna liczbę pracowników pracujących w sklepie i w dziale każdego pracownika. Wie również, że pracownicy nie nadepną na siebie, a pracownicy staną w przejściu, a nie na półkach sklepowych. Pracownicy opuszczają swój własny dział, aby pomóc klientom zlokalizować towary w innych działach lub sprawdzić zapasy. Analityk podający lokalizację wszystkich pracowników w sklepie w wybranym momencie bez zaglądania do środka jest jak chemik obliczający MO molekuły. Tak jak MOs nie mogą podać dokładnej lokalizacji każdego elektronu, tak dokładne położenie każdego pracownika nie jest znane. MO posiadający płaszczyznę węzłową jest jak wniosek, że pracownicy chodzą po korytarzach, a nie po półkach. Chociaż elektrony pochodzą z konkretnego atomu, to jednak elektron wypełnia MO bez względu na swój atom źródłowy. To tak, jakby pracownik opuszczał swój dział, by w ciągu dnia chodzić gdzie indziej w sklepie. Tak więc, MO jest niekompletnym opisem elektronu, tak jak obliczenia analityka na temat niewidzialnego sklepu są niekompletnym zgadywaniem na temat lokalizacji pracowników.

Obliczanie MO jest jak przewidywanie lokalizacji każdego pracownika w sklepie z artykułami budowlanymi.
Tworzenie orbit molekularnych
Chemicy teoretyczni wymyślili zasady obliczania MO. Reguły te pochodzą ze zrozumienia mechaniki kwantowej. Mechanika kwantowa pomaga chemikom wykorzystać to, co fizycy powiedzieli o elektronach, aby ustalić, jak zachowują się one w cząsteczkach. Orbity molekularne powstają w wyniku "dozwolonych" oddziaływań pomiędzy orbitami atomowymi. (Oddziaływania te są "dozwolone", jeżeli symetrie (określone na podstawie teorii grupowej) orbit atomowych są ze sobą kompatybilne). Chemicy badają oddziaływania z orbitami atomowymi. Oddziaływania te pochodzą z nakładania się (miara tego, jak dobrze dwie orbity konstruktywnie oddziałują na siebie) pomiędzy dwoma orbitami atomowymi. Nakładanie się jest ważne, jeżeli orbity atomowe są blisko siebie pod względem energetycznym. W końcu, liczba MO w cząsteczce musi być równa liczbie orbit atomowych w atomach, które są połączone, aby utworzyć cząsteczkę.
Podejście jakościowe
Chemicy muszą zrozumieć geometrię MOs, aby omówić strukturę molekularną. Metoda LCMO (Linear combination of atomic orbitals molecular orbital) daje przybliżony, ale dobry opis MOs. W tej metodzie, orbity molekularne są wyrażone jako liniowe kombinacje wszystkich orbit atomowych każdego atomu w cząsteczce.
Liniowe kombinacje orbit atomowych (LCAO)
Orbitale molekularne zostały po raz pierwszy wprowadzone przez Friedricha Hunda i Roberta S. Mullikena w 1927 i 1928 roku.
Liniowe połączenie orbit atomowych lub przybliżenie "LCAO" dla orbit molekularnych zostało wprowadzone w 1929 roku przez Sir Johna Lennarda-Jonesa. Jego przełomowy artykuł pokazał, jak wyprowadzić elektroniczną strukturę cząsteczek fluoru i tlenu z zasad kwantowych. To jakościowe podejście do molekularnej teorii orbitalnej jest częścią początków współczesnej chemii kwantowej.
Liniowe kombinacje orbit atomowych (LCAO) mogą być używane do odgadywania orbit molekularnych, które powstają, gdy atomy cząsteczki łączą się ze sobą. Podobnie jak w przypadku orbity atomowej, równanie Schrodingera, które opisuje zachowanie się elektronu, może być skonstruowane również dla orbity molekularnej. Liniowe kombinacje orbit atomowych, (sumy i różnice fali atomowej) dostarczają przybliżonych rozwiązań dla molekularnych równań Schrodingera. Dla prostych molekuł okrzemkowych, fale, które otrzymujemy, są reprezentowane matematycznie przez równania
Ψ = caψa + cbψb
oraz
Ψ* = caψa - cbψb
gdzie Ψ i Ψ* są falami molekularnymi dla orbit molekularnych wiążących i przeciwwiążących, odpowiednio ψa i ψb są falami atomowymi z atomów a i b, odpowiednio, a ca i cb są współczynnikami regulowanymi. Współczynniki te mogą być dodatnie lub ujemne, w zależności od energii i symetrii poszczególnych orbit atomowych. Gdy dwa atomy zbliżają się do siebie, ich orbity atomowe nakładają się na siebie, tworząc obszary o dużej gęstości elektronów. Tak więc, molekularne orbity są tworzone pomiędzy dwoma atomami. Atomy są trzymane razem przez elektrostatyczne przyciąganie pomiędzy dodatnio naładowanymi jądrami i ujemnie naładowanymi elektronami zajmującymi wiążące orbity molekularne.
Wiązania, Antibonding i Nonbonding MOs
Kiedy orbity atomowe oddziaływują na siebie, powstająca orbita molekularna może mieć trzy rodzaje: wiążącą, antywiążącą lub nie wiążącą.
Klejenie MO:
- Oddziaływania wiążące pomiędzy orbitami atomowymi są oddziaływaniami konstrukcyjnymi (w fazie).
- Wiążące się MO są mniej energochłonne niż orbity atomowe, które łączą się, aby je wytworzyć.
Antibonding MOs:
- Oddziaływania antywibondingowe pomiędzy orbitami atomowymi są oddziaływaniami destrukcyjnymi (poza fazami).
- Antybondingowe MOs mają wyższą energię niż orbity atomowe, które łączą się, aby je produkować.
Niewiążące się MO:
- Niewiążące się MO są wynikiem braku interakcji pomiędzy orbitami atomowymi z powodu braku kompatybilnych symetrii.
- Niewiążące się MO będą miały taką samą energię jak orbity atomowe jednego z atomów w cząsteczce.
HOMO i LUMO
Każda orbita molekularna ma swój własny poziom energii. Chemicy sortują MO według poziomów energii. Chemicy zakładają, że elektrony najpierw wypełnią MO o najniższym poziomie energetycznym. Na przykład, jeśli cząsteczka ma elektrony do wypełnienia 15 orbit, 15 MO z najniższym poziomem energii zostanie wypełnionych. 15 MO na liście będzie nazywane "najwyżej zajętą orbitą molekularną" (HOMO), a 16 MO na liście będzie "najniżej zajętą orbitą molekularną" (LUMO). Różnica w poziomie energii HOMO i LUMO nazywana jest luką pasmową. Luka pasmowa może czasami służyć jako miara pobudliwości cząsteczki: im mniejsza energia, tym łatwiej będzie ją pobudzić. Kiedy elektron jest wzbudzony, przeskakuje do niezamieszkałego MO. Na przykład, może to pomóc w zgadywaniu, czy coś da światło (luminescencja).
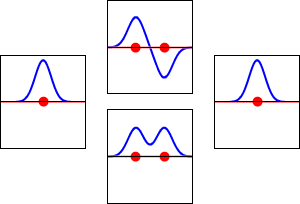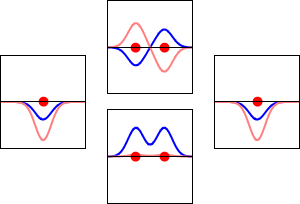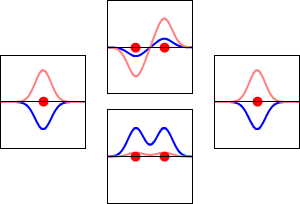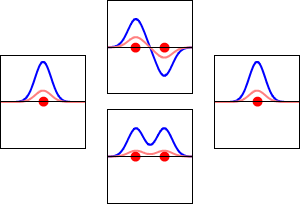
Fale elektronowe dla orbity 1s atomu wodoru (lewa i prawa) i odpowiadających im wiązań (dolna) oraz antyzwiązanych (górna) orbit molekularnych cząsteczki H2. Rzeczywistą częścią funkcji falowej jest krzywa niebieska, a wyobrażoną krzywa czerwona. Czerwone kropki oznaczają lokalizacje protonów. Fala elektronowa oscyluje zgodnie z równaniami falowymi Schrödingera, a orbity są jego falami stojącymi. Częstotliwość fali stojącej jest proporcjonalna do energii orbity. (Ten wykres jest jednowymiarowym przekrojem przez układ trójwymiarowy).
Pytania i odpowiedzi
P: Co to jest orbital molekularny?
A: Orbital molekularny (lub MO) to funkcja matematyczna, która opisuje falowe zachowanie elektronu w cząsteczce. Wyjaśnia ona, co dzieje się z elektronami, gdy atomy łączą się w cząsteczkę i może określić prawdopodobieństwo znalezienia elektronu w dowolnym określonym regionie.
P: Jak chemicy budują modele matematyczne orbitali molekularnych?
O: Chemicy zazwyczaj budują modele matematyczne orbitali molekularnych poprzez łączenie orbitali atomowych. Można również wykorzystać orbitale hybrydowe z każdego atomu cząsteczki lub inne orbitale molekularne z grup atomów. Komputery mogą pracować na tych funkcjach.
P: Co mechanika kwantowa ma wspólnego z badaniem cząsteczek?
O: Orbitale molekularne pozwalają chemikom stosować mechanikę kwantową do badania cząsteczek. Odpowiadają one na pytania, jak atomy w cząsteczkach trzymają się razem i dają wgląd we właściwości chemiczne i fizyczne.
P: Co to są diagramy orbitalne?
O: Diagramy orbitalne to wizualne przedstawienia, które wskazują, gdzie najprawdopodobniej znajdują się elektrony w atomie na podstawie jego różnych zaokrąglonych kształtów.
P: Jak działają orbitale hybrydowe?
O: Orbitale hybrydowe łączą różne typy orbitali atomowych w jeden nowy typ, który ma unikalne cechy w porównaniu do jego części składowych. Takie hybrydy są często wykorzystywane przy tworzeniu modeli matematycznych dla orbitali molekularnych.
P: Jak komputery mogą pomóc w badaniu MO?
O: Komputery mogą pomóc w badaniu MO, pracując nad ich funkcjami i zapewniając dokładniejsze przewidywania lub wyjaśnienia właściwości chemicznych i fizycznych w cząsteczkach.
Przeszukaj encyklopedię