Reakcje cheletropowe
Reakcje cheletropowe są rodzajem reakcji pericyklicznej, w której jeden atom na jednym z reagentów otrzymuje dwa nowe wiązania. Reakcja pericykliczna to taka, która obejmuje stan przejściowy z cyklicznym układem atomów i związanym z nim cyklicznym układem oddziałujących orbitali. W tym cyklicznym układzie zachodzi reorganizacja wiązań σ i π.
Reakcje cheletropowe są podklasą cykloaddycji. To, co odróżnia reakcje cheletropowe od innych, to fakt, że w przypadku jednego z reagentów oba nowe wiązania są tworzone z tym samym atomem. Kilka przykładów pokazano po prawej stronie na Rysunku 1. W pierwszym przypadku, pojedynczym atomem jest atom węgla w grupie karbonylowej. Ten atom węgla kończy się w tlenku węgla. Efektem końcowym jest utworzenie dwóch nowych wiązań z jednym atomem. Pierwsze dwa przykłady znane są jako "wytrącenia cheletropowe", ponieważ w reakcji wydzielana jest mała stabilna cząsteczka. Siłą napędową tych reakcji jest często korzyść entropowa wynikająca z uwolnienia gazu (np. CO lub N2).
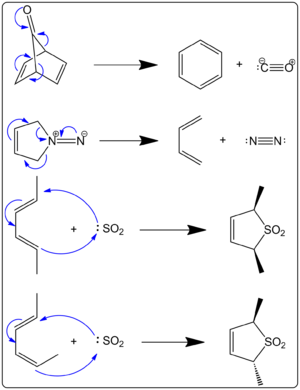
Rysunek 1. Reakcje pericykliczne
Analiza teoretyczna
Ze względu na geometrię cząsteczek biorących udział w reakcjach cheletropowych, potwierdzają one szereg przewidywań poczynionych przez chemików teoretycznych. Reakcje cheletropowe potwierdzają zachowanie symetrii orbitali molekularnych.
W perycyklicznym stanie przejściowym, mała cząsteczka oddaje dwa elektrony do pierścienia. Dwie możliwe geometrie mogą wyjaśnić tę reakcję. Mała cząsteczka może zbliżać się w sposób liniowy lub nieliniowy. W podejściu liniowym, elektrony na orbitalu małej cząsteczki są skierowane bezpośrednio na układ π dużej cząsteczki. W przypadku podejścia nieliniowego, orbitale zbliżają się pod nieco innym kątem. Zdolność układu π do rotacji w miarę zbliżania się małej cząsteczki jest kluczowa dla tworzenia nowych wiązań. Kierunek rotacji będzie różny w zależności od tego, ile π-elektronów znajduje się w układzie. Poniżej przedstawiony jest schemat dwuelektronowego fragmentu zbliżającego się do czteroelektronowego π-systemu przy użyciu granicznych orbitali molekularnych. Rotacja będzie dezrotacyjna, jeżeli mała cząsteczka zbliża się liniowo i konrotacyjna, jeżeli cząsteczka zbliża się nieliniowo. Dysrotacyjne i konrotacyjne mówią, w jaki sposób rotują wiązania w układzie π. Dysrotacyjne oznaczają przeciwne kierunki, natomiast konrotacyjne - ten sam kierunek. Jest to również pokazane na poniższym schemacie.
Używając reguły Huckela, można stwierdzić, czy układ π jest aromatyczny czy antyaromatyczny. Jeśli jest aromatyczny, to w podejściu liniowym stosuje się ruch dyskretny, a w podejściu nieliniowym ruch konrotacyjny. Odwrotnie jest w przypadku układu antyaromatycznego. Podejścia liniowe będą miały ruch konrotacyjny, podczas gdy podejścia nieliniowe będą miały ruch dysrotacyjny.
Reakcje cheletropijne z udziałem SO2
Termodynamika
Kiedy dwutlenek siarki reaguje z butadienem i izoprenem, powstają dwa różne produkty. Mechanizm reakcji decyduje o tym, co powstanie. Możliwy jest zarówno produkt kinetyczny, jak i produkt termodynamiczny. Większa ilość produktu termodynamicznego powstaje niż kinetycznego. Produkt kinetyczny pochodzi z reakcji Dielsa-Aldera, podczas gdy reakcja cheletropowa tworzy bardziej stabilny termodynamicznie produkt. Szlak cheletropowy jest częściej wykorzystywany, ponieważ prowadzi do bardziej stabilnego adduktu z pierścieniem pięcioczłonowym. Poniższy schemat pokazuje różnicę pomiędzy tymi dwoma produktami. Ścieżka po lewej stronie pokazuje produkt termodynamiczny, podczas gdy ścieżka po prawej stronie pokazuje produkt kinetyczny. Suarez i Sordo wykazali to w 1995 roku. Pokazali to zarówno eksperymentalnie jak i za pomocą obliczeń gaussowskich.
Kinetyka
Jednym z przykładów jest reakcja cheletropowa 1,3-dienów z dwutlenkiem siarki. Chemicy dokładnie przyjrzeli się kinetyce tej reakcji. W 1976 r. Isaacs i Laila zmierzyli współczynniki kenetyczne dla addycji ditlenku siarki do pochodnych butadienu. Szybkość addycji była monitorowana w benzenie w temperaturze 30 °C z początkowym dwudziestokrotnym nadmiarem dieny. Do pomiaru zaniku SO2 użyto spektrofotometru do badania światła przy 320 nm. Reakcja wykazywała "pseudo kinetykę pierwszego rzędu". Chemicy stwierdzili, że grupy odbierające elektrony na dienie zmniejszają szybkość reakcji. Ponadto, na szybkość reakcji znaczący wpływ miały efekty steryczne 2-podstawników, przy czym bardziej nieporęczne grupy zwiększały szybkość reakcji. (Innymi słowy, im większa grupa atomów zwisających z drugiego atomu węgla, tym reakcja przebiegała szybciej). Autorzy przypisują to tendencji nieporęcznych grup do faworyzowania konformacji cisoidalnej dieny, która jest niezbędna w reakcji (patrz tabela poniżej). Dodatkowo, dla siedmiu dienów zmierzono szybkość reakcji w czterech temperaturach. Na podstawie tych pomiarów chemicy wykorzystali równanie Arrheniusa do obliczenia entalpii aktywacji (ΔH‡) i entropii aktywacji (ΔS‡) dla każdej reakcji. Była to jedna z pierwszych ważnych prób zbadania kenetyki reakcji cheletropowej.
| -Butadien | 104 k /min-1 (30 °C) (± 1-2%) absolutny | 104 k /min-1 (30 °C) (± 1-2%) względne | ΔH‡ /kcal mol-1 | ΔS‡ /cal mol-1 K-1 |
| 2-metylo | 1.83 | 1.00 | 14.9 | -15 |
| 2-etyl | 4.76 | 2.60 | 10.6 | -20 |
| 2-izopropyl | 13.0 | 7.38 | 12.5 | -17 |
| 2-tert-butyl | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentylu | 17.2 | 9.4 | 11.6 | -18 |
| 2-klor | 0.24 | 0.13 | N/A | N/A |
| 2-bromoetylu | 0.72 | 0.39 | N/A | N/A |
| 2-p-tolil | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenyl | 17.3 | 9.45 | N/A | N/A |
| 2-(p-bromofenyl) | 9.07 | 4.96 | N/A | N/A |
| 2,3-dimetylo | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-metylo | 0.18 | 0.10 | N/A | N/A |
| trans-1-metylo | 0.69 | 0.38 | N/A | N/A |
| 1,2-dimetylo-cykloheksan | 24.7 | 13.5 | 11.4 | -16 |
| 2-metylo-1,1,4,4-d4 | 1.96 | N/A | N/A | N/A |
Monnat, Vogel i Sordo, w 2002 roku, zmierzyli kinetykę addycji dwutlenku siarki do 1,2-dimetyloidenocykloalkanów. Napisali oni, że reakcja 1,2-dimetyloidenocykloheksanu z dwutlenkiem siarki może dawać dwa różne produkty w zależności od warunków reakcji. Pod kontrolą kinetyczną (≤ -60 °C) reakcja tworzy odpowiednią sułtynę w reakcji hetero-Dielsa-Aldera, natomiast pod kontrolą termodynamiczną (≥ -40 °C) reakcja tworzy odpowiedni sulfolen w reakcji cheletropowej. Entalpia aktywacji dla reakcji hetero-Dielsa-Aldera jest o ok. 2 kcal/mol mniejsza niż dla odpowiadającej jej reakcji cheletropowej. Sulfolen jest o ok. 10 kcal/mol bardziej stabilny niż izometryczna sułtanka w roztworze CH2Cl2/SO2.
Autorom udało się doświadczalnie opracować prawo szybkości reakcji 1,2-dimetyloidenocykloheksanu z dwutlenkiem siarki w temperaturze 261,2 K, dając odpowiedni sulfolen. Reakcja była pierwszego rzędu w 1,2-dimetyloidenocykloheksanie, ale drugiego rzędu w ditlenku siarki (patrz poniżej). Potwierdziło to przewidywania chemików teoretycznych oparte na obliczeniach kwantowych wysokiego poziomu ab initio. Wykorzystując metody obliczeniowe, autorzy zaproponowali strukturę przejściową dla cheletropowej reakcji 1,2-dimetyloidenocykloheksanu z ditlenkiem siarki (patrz rysunek po prawej). Reakcja jest drugiego rzędu w dwutlenku siarki, ponieważ inna cząsteczka dwutlenku siarki prawdopodobnie wiąże się ze stanem przejściowym, aby pomóc w jego stabilizacji. Podobne wyniki uzyskano w badaniach przeprowadzonych w 1995 r. przez Suareza, Sordo i Sordo, którzy wykorzystali obliczenia ab initio do zbadania kinetycznej i termodynamicznej kontroli reakcji dwutlenku siarki z 1,3-dienami.
d [ 3 ] d t = k 2 [ 1 ] [ S O 2 ] 2 {{displaystyle {{frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}}
Wpływ rozpuszczalnika
Zbadano kinetycznie wpływ rozpuszczalnika na przebieg cheletropowej reakcji 3,4-dimetylo-2,5-dihydrotiofen-1,1-ditlenku (rys. 1) w 14 rozpuszczalnikach. Stwierdzono, że stałe szybkości reakcji w przód i w tył, a także stałe równowagi są liniowo skorelowane ze skalą polarności rozpuszczalnika ET(30).
Reakcje prowadzono w temperaturze 120 °C i badano metodą spektroskopii 1H-NMR mieszaniny reakcyjnej. Stwierdzono, że szybkość reakcji w przód k1 maleje o współczynnik 4,5 przy przejściu z cykloheksanu do metanolu. Stwierdzono, że szybkość odwrotna k-1 wzrasta o współczynnik 53 przy przejściu z cykloheksanu do metanolu, a stała równowagi Keq maleje o współczynnik 140. Sugeruje się, że podczas procesu aktywacji zachodzi zmiana polarności, o czym świadczą zależności pomiędzy danymi równowagowymi i kinetycznymi. Autorzy twierdzą, że na przebieg reakcji wydaje się wpływać polarność rozpuszczalnika, a świadczyć o tym może zmiana momentów dipolowych przy przechodzeniu od reagenta do stanu przejściowego i produktu. Autorzy stwierdzają również, że na reakcję cheletropową nie wydaje się mieć wpływu ani kwasowość ani zasadowość rozpuszczalnika.
Wyniki tego badania skłaniają autorów do oczekiwania następujących zachowań:
1. Zmiana polarności rozpuszczalnika będzie miała mniejszy wpływ na szybkość niż równowaga.
2. Stałe szybkości będą charakteryzowały się przeciwnym wpływem na polaryzację: k1 będzie nieznacznie malało wraz ze wzrostem ET(30), a k-1 będzie rosło w tych samych warunkach.
3. Wpływ na k-1 będzie większy niż na k1.
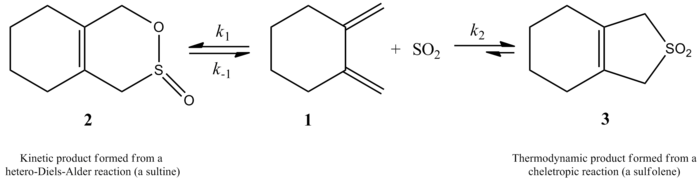
Reakcja 1,2-dimetyloidenocykloheksanu z SO2 daje sułtynę w reakcji Hetero-Dielsa-Aldera pod kontrolą kinetyczną lub sulfolen w reakcji cheletropowej pod kontrolą termodynamiczną
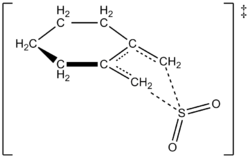
Proponowany stan przejściowy dla reakcji 1,2-dimetyloidenocykloheksanu z SO2 dającej sulfolen na drodze reakcji cheletropowej
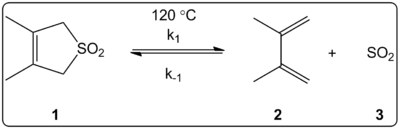
Reakcja cheletropowa badana w różnych rozpuszczalnikach
Addycja karbenu do alkenów
Jedną z najważniejszych reakcji cheletropowych jest dodanie karbenu singletowego do alkenu w celu otrzymania cyklopropanu (patrz rysunek po lewej). Karben jest neutralną cząsteczką zawierającą węgiel dwuwartościowy z sześcioma elektronami w powłoce walencyjnej. Z tego powodu karbeny są wysoce reaktywnymi elektrofilami i powstają jako intermediaty reakcji. Karben singletowy zawiera pusty orbital p oraz orbital hybrydowy sp2, który posiada dwa elektrony. Karbeny singletowe przyłączają się stereospecyficznie do alkenów, a stereochemia alkenu jest zachowana w produkcie cyklopropanu. Mechanizm addycji karbenu do alkenu polega na zgodnej [2+1] cykloaddycji (patrz rysunek). Karbeny otrzymane z chloroformu lub bromoformu mogą być użyte do dodania CX2 do alkenu w celu otrzymania dihalocyklopropanu, podczas gdy odczynnik Simmonsa-Smitha dodaje CH2.
Oddziaływanie wypełnionego orbitalu karbenu z układem π alkenu tworzy układ czteroelektronowy i sprzyja podejściu nieliniowemu. Korzystne jest również mieszanie pustego orbitalu p karbenu z wypełnionym orbitalem π alkenu. Korzystne mieszanie zachodzi poprzez podejście nieliniowe (patrz rysunek 2 po prawej). Jednakże, podczas gdy teoria wyraźnie faworyzuje podejście nieliniowe, nie ma oczywistych implikacji doświadczalnych dla podejścia liniowego i nieliniowego.
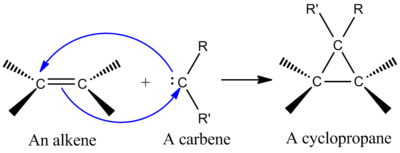
Dodanie karbenu do alkenu w celu utworzenia cyklopropanu
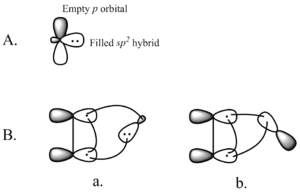
Rysunek 2. A) Orbitale dla singletowych karbenów B) Nieliniowe podejście do a) Orbitalu sp2 karbenu i b) Orbitalu p karbenu
Pytania i odpowiedzi
P: Co to jest reakcja cheletropowa?
O: Reakcja cheletropowa to rodzaj reakcji pericyklicznej, w której jeden atom na jednym z reagentów otrzymuje dwa nowe wiązania.
P: Co to jest reakcja pericykliczna?
O: Reakcja pericykliczna to taka, w której występuje stan przejściowy z cyklicznym układem atomów i związanym z nim cyklicznym układem oddziałujących orbitali, w którym następuje reorganizacja wiązań َ i ً.
P: Czym różnią się one od innych typów reakcji?
O: Reakcje cheletropowe są podklasą cykloaddycji i od innych typów reakcji odróżnia je to, że na jednym z reagentów oba nowe wiązania są tworzone do tego samego atomu.
P: Jakie są przykłady?
O: Przykładem mogą być "ekstrakcje cheletropowe", takie jak ta, w której pojedynczy atom w grupie karbonylowej kończy się w tlenku węgla.
P: Co napędza te reakcje?
O: Siłą napędową tych reakcji jest często korzyść entropowa z uwolnienia gazu (np. CO lub N2).
P: Czy rysunek 1 dotyczy reakcji cheletropowych? O: Tak, rysunek 1 przedstawia przykłady reakcji cheletropowych.
Przeszukaj encyklopedię
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)