rotacyjny i rotacyjny
Terminy te opisują dwie klasy reakcji elektrocyklicznej (rodzaj organicznej reakcji chemicznej). W trybie rotacyjnym, podstawniki umieszczone na końcach sprzężonego układu wiązań podwójnych poruszają się w tym samym (zgodnym lub przeciwnym) kierunku podczas otwierania lub zamykania pierścienia. W trybie rotacyjnym przesuwają się one w przeciwnych kierunkach.
Przykładem jest konwersja trans-cis-trans-2,4,6-oktatrienu na cis-dimetylocykloheksadien (góra rysunku). Mechanika orbitalna reakcji potrzebuje trybu rotacyjnego. Symetria orbitalna najwyżej położonego orbitala molekularnego oktatrienu (HOMO) wymaga, aby orbity końca pi poruszały się w przeciwnych kierunkach w celu utworzenia prawidłowej symetrii znajdującej się w wiązaniu sigma.

Termiczne przestawienia wszystkich układów sprzężonych zawierających elektron 4n + 2 pi są stereospecyficzne. Opiera się to na zachowaniu symetrii orbitalnej w najwyżej zajmowanej orbicie molekularnej. Układy zawierające 4n pi elektronów wykazują odwrotny tryb rotacyjny. Dotyczy to również przekrojów elektronów 4n + 2 pi (gdzie n jest liczbą całkowitą) napędzanych światłem (fotoindukowanych). Fotoindukowane przestawienia układów 4n pi (gdzie n jest liczbą całkowitą) elektronów napędzanych światłem (fotoindukowane) są zgodne z zasadą rotacji.
Zasady Woodwarda-Hoffmanna podsumowują powyższe różne reakcje.
Poniższy rysunek pokazuje również różnicę między reakcjami rotacyjnymi i rotacyjnymi:
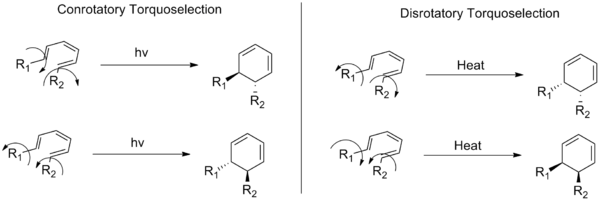
Tryby rotacji rotacyjnej i rotacyjnej, z których każdy pokazuje dwa możliwe kierunki rotacji, w wyniku których powstają pary enancjomerów dla ogólnego układu heksatriennego.
Pytania i odpowiedzi
P: Co to jest reakcja elektrocykliczna?
O: Reakcja elektrocykliczna to rodzaj organicznej reakcji chemicznej, w której układ sprzężonych wiązań podwójnych otwiera się lub zamyka, tworząc pierścień.
P: Jaka jest różnica między trybem konrotacyjnym i dezrotacyjnym?
O: W trybie konrotacyjnym podstawniki znajdujące się na końcach sprzężonego systemu podwójnych wiązań poruszają się w tym samym kierunku (zgodnie z ruchem wskazówek zegara lub przeciwnie do ruchu wskazówek zegara) podczas otwierania lub zamykania pierścienia. Natomiast w trybie dezrotacyjnym poruszają się one w przeciwnych kierunkach.
P: Jak symetria orbitalna wpływa na te reakcje?
O: Mechanikę orbitalną reakcji należy wziąć pod uwagę przy określaniu, czy przebiega ona zgodnie z zasadami konrotacyjnymi czy dezrotacyjnymi. Na przykład, układy zawierające 4n + 2 elektrony pi są stereospecyficzne i podlegają regule konrotacyjnej ze względu na zachowanie symetrii orbitalnej w ich najwyżej położonych orbitalach molekularnych (HOMO). Układy zawierające 4n elektronów pi wykazują przeciwny tryb dezrotacyjny. Tak samo jest w przypadku rearanżacji 4n + 2 pi (gdzie n jest liczbą całkowitą) elektronów napędzanych przez światło (fotoindukcja). Fotoindukowane rearanżacje układów 4n pi elektronów (gdzie liczba elektronów jest podzielna przez 4) podlegają regule dezrotacyjnej.
P: Co to jest reguła Woodwarda-Hoffmanna?
O: Reguły Woodwarda-Hoffmanna podsumowują różne typy reakcji elektrocyklicznych i to, jak wpływają na nie takie czynniki jak symetria orbitalna i obecność/braki energii świetlnej.
P: Co przedstawia ten rysunek?
O: Obrazek przedstawia przykładową przemianę trans-cis-trans-2,4,6-oktatrienu w cis-dimetylocykloheksadien i ilustruje, jak podstawniki przemieszczają się inaczej w zależności od tego, czy zachodzi to w trybie conorotary czy disrorotary - odpowiednio zgodnie z ruchem wskazówek zegara i przeciwnie do ruchu wskazówek zegara, patrząc z góry.
Przeszukaj encyklopedię