Hemoglobina — co to jest, budowa i rola w organizmie
Hemoglobina — czym jest, budowa i rola w organizmie. Dowiedz się, jak hemoglobina w czerwonych krwinkach transportuje tlen i CO2 oraz wpływa na zdrowie.
Hemoglobina jest białkiem występującym przede wszystkim w czerwonych krwinkach, które zawiera żelazo i pełni centralną rolę w transporcie tlenu w organizmie człowieka. Obecna jest w czerwonych krwinkach większości kręgowców z wyjątkiem niektórych ryb (tzw. ryb białokrwistych); występuje też u wielu bezkręgowców, natomiast inne grupy zwierząt korzystają z innych barwników transportujących tlen, np. z hemocyjaniny.
Hemoglobina uczestniczy nie tylko w pobieraniu i oddawaniu tlenu — bierze też udział w przewozie i regulacji innych gazów i jonów. Przenosi około 20–25% dwutlenku węgla wydalanego z tkanek oraz wiąże protony (H+), co pomaga utrzymać równowagę kwasowo‑zasadową organizmu. Czerwone krwinki zawdzięczają swój kolor hemoglobinie: gdy do hemoglobiny jest przyłączony tlen, powstaje oksyhemoglobina, a krew staje się jaśniejsza; hemoglobina odtlenowana ma ciemniejszy, nieco sinawy odcień.
Budowa molekularna
Jedna cząsteczka hemoglobiny składa się z czterech podjednostek globinowych (dwa łańcuchy α i dwa łańcuchy β w hemoglobinie dorosłych — HbA) oraz czterech grup hemowych zawierających jon żelaza w stanie Fe2+. Każda grupa hemowa może przyłączyć jedną cząsteczkę O2, więc pełna cząsteczka hemoglobiny może przenieść do czterech cząsteczek tlenu. U płodu dominującą formą jest HbF (α2γ2), która ma większe powinowactwo do tlenu niż HbA, co ułatwia przepływ tlenu z krwi matki do płodu.
Właściwości funkcjonalne
- Kooperatywność: przyłączanie tlenu do jednej podjednostki ułatwia przyłączanie tlenu do pozostałych — stąd charakterystyczna sigmoidalna krzywa dysocjacji tlenu.
- Efekt Bohra: obniżenie pH (wzrastające stężenie H+) i zwiększenie pCO2 przesuwają krzywą dysocjacji w prawo, ułatwiając uwalnianie tlenu w tkankach aktywnych metabolicznie.
- Wpływ 2,3‑BPG: obecność 2,3‑bifosfoglicerynianu w erytrocytach obniża powinowactwo hemoglobiny do tlenu, co sprzyja uwalnianiu O2 w tkankach.
- Transport CO2 i jonów: część CO2 jest transportowana w postaci karbaminianów związanych z grupami aminowymi globin lub jako HCO3− po przekształceniu w erytrocytach.
Synteza i cykl życia
Hemoglobina jest syntetyzowana w erytroblastach w szpiku kostnym. Synteza grupy hemowej rozpoczyna się w mitochondriach od kondensacji glicyny i bursztynylo‑CoA przy udziale syntazy ALA; końcowe włączenie żelaza do protoporfiryny IX dokonuje się dzięki enzymowi ferrochelatazie. Dojrzałe erytrocyty, pozbawione jąder, nie syntetyzują już nowych białek; żyją przeciętnie około 120 dni, po czym są usuwane głównie przez śledzionę, a uwolnione żelazo jest recyrkulowane do ponownej syntezy hemoglobiny.
Znaczenie kliniczne
- Normy stężenia hemoglobiny (przykładowe, mogą się różnić w zależności od laboratorium): mężczyźni ~13,8–17,2 g/dl (138–172 g/l), kobiety ~12,1–15,1 g/dl (121–151 g/l).
- Anemia — zmniejszone stężenie hemoglobiny prowadzi do osłabienia, duszności, bladości skóry i obniżonej wydolności; przyczyny: niedobór żelaza, przewlekłe choroby, zaburzenia syntezy globin (np. talasemie), utrata krwi, niedobór witamin (B12, foliany).
- Policytemia (nadkrwistość) — podwyższone stężenie hemoglobiny może wynikać z odwodnienia, chorób płuc, zwiększonej produkcji erytropoetyny lub rzadkich pierwotnych zaburzeń szpiku.
- Choroby hemoglobinowe: mutacje w genach globinowych dają m.in. anemię sierpowatą (mutacja w łańcuchu β — hemoglobina S) i talasemie (zmniejszona synteza łańcuchów α lub β), co prowadzi do nieprawidłowej struktury hemoglobiny i różnych objawów klinicznych.
- Zatrucia i zaburzenia wiązania: dwutlenek węgla i produkty przemiany mogą wpływać na funkcję hemoglobiny. Tlenek węgla (CO) konkuruje z O2 o miejsce wiązania, tworząc karboksyhemoglobinę i znacznie obniżając zdolność transportową krwi; methemoglobinemia (utlenienie Fe2+ do Fe3+) uniemożliwia wiązanie tlenu i powoduje sinicę — przyczyną mogą być niektóre leki, nitraty lub wrodzone defekty enzymatyczne.
Diagnostyka i pomiary
Stężenie hemoglobiny oznacza się rutynowo w morfologii krwi (CBC). Saturację tlenem (SpO2) mierzy pulsoksymetr, który ocenia procentowo stopień wysycenia hemoglobiny tlenem, ale nie rozróżnia form nieczynnych (np. karboksy‑ czy methemoglobiny). Gazometria krwi tętniczej pozwala ocenić pO2 i zawartość tlenu we krwi oraz stwierdzić zaburzenia kwasowo‑zasadowe.
Występowanie i warianty
Poza hemoglobiną u różnych organizmów spotykane są inne barwniki transportujące tlen — np. wspomniana hemocyjanina u mięczaków i skorupiaków (z miedzią zamiast żelaza). Wśród hemoglobin istnieje wiele wariantów genetycznych i posttranslacyjnych; niektóre są bezobjawowe, inne powodują znaczące choroby hematologiczne.
Podsumowując: hemoglobina to kluczowe białko odpowiedzialne za transport tlenu i udział w wymianie gazowej oraz równowadze kwasowo‑zasadowej organizmu. Jej struktura (podjednostki globinowe i grupy hemowe) oraz właściwości (kooperatywność, efekt Bohra) determinują efektywność dostarczania tlenu do tkanek; zaburzenia budowy lub ilości hemoglobiny prowadzą do istotnych konsekwencji zdrowotnych.
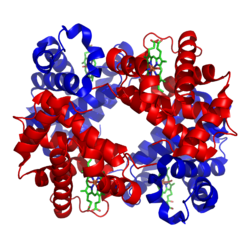
Struktura ludzkiej hemoglobiny. Podjednostki α i β są w kolorze czerwonym i niebieskim. Grupy hemowe zawierające żelazo w kolorze zielonym.
Struktura
Najczęściej spotykany typ hemoglobiny u ssaków zawiera cztery takie podjednostki. Każda podjednostka hemoglobiny jest białkiem globularnym (globiną) z grupą hemową wewnątrz niej. Każda grupa hemowa ma jeden atom żelaza. Wiąże on jedną cząsteczkę tlenu. Tak więc kompletna cząsteczka hemoglobiny ma cztery łańcuchy globiny, cztery cząsteczki hemu i cztery atomy żelaza. Kiedy hemoglobina znajduje się w płucach, zbiera tlen w swoich hemach i przenosi go do reszty ciała.
Rozpracowanie jej struktury zajęło lata. Max Perutz i John Kendrew opracowali najpierw strukturę mioglobiny. Ta globina mięśniowa jest mniejsza, ma tylko jedną grupę hemową.
Pytania i odpowiedzi
Q: Czym jest hemoglobina?
O: Hemoglobina to białko w czerwonych krwinkach, które zawiera żelazo i służy do transportu tlenu w ludzkim ciele.
P: Gdzie znajduje się hemoglobina?
O: Hemoglobina znajduje się w czerwonych krwinkach wszystkich kręgowców z wyjątkiem ryb białokrwistych. Występuje również u niektórych bezkręgowców.
P: Czego niektóre bezkręgowce używają zamiast hemoglobiny?
O: Niektóre bezkręgowce używają innych substancji chemicznych, takich jak hemocyjanina.
P: W transport jakich innych gazów zaangażowana jest hemoglobina?
O: Hemoglobina bierze udział w transporcie innych gazów poza tlenem. Przenosi ona część dwutlenku węgla wydychanego przez organizm (około 20-25% całości).
P: Co nadaje czerwonym krwinkom ich kolor?
O: Czerwone krwinki zawdzięczają swój kolor hemoglobinie, która jest czerwona.
P: Ile cząsteczek hemoglobiny znajduje się w każdej czerwonej krwince?
O: W każdej czerwonej krwince znajdują się miliony cząsteczek hemoglobiny.
P: Ile czerwonych krwinek znajduje się w ludzkim ciele?
O: W ludzkim ciele znajdują się miliony czerwonych krwinek.
Przeszukaj encyklopedię